Nel 1869 Dmitri Mendeleev pubblicò un documento intitolato "Sulla relazione delle proprietà degli elementi con i loro pesi atomici". In quella carta ha prodotto una disposizione ordinata degli elementi, elencandoli in ordine di aumento di peso e disponendoli in gruppi basati su proprietà chimiche simili. Sebbene siano rimasti molti decenni prima che venissero scoperti i dettagli della struttura atomica, la tabella di Mendeleev già organizzava elementi in termini di valenza.
Elementi e peso atomico
Nel tempo di Mendeleev si pensava che gli atomi fossero entità indivisibili, uniche . Alcuni erano più pesanti di altri e sembrava ragionevole ordinare gli elementi aumentando di peso. Ci sono due problemi con questo approccio. Innanzitutto, misurare il peso è un compito difficile e molti dei pesi accettati ai tempi di Mendeleev non erano corretti. In secondo luogo, si scopre che il peso atomico non è in realtà il parametro rilevante. Le tavole periodiche odierne collocano gli elementi in ordine di numero atomico, che è il numero di protoni nel nucleo. Ai tempi di Mendeleev, i protoni non erano ancora stati scoperti.
Elementi e proprietà chimiche
Mendeleev scrisse che "la disposizione secondo il peso atomico corrisponde alla valenza dell'elemento e in una certa misura alla differenza nel comportamento chimico ". La valenza, nella comprensione di Mendeleev, era un'indicazione della capacità di un elemento di combinarsi con altri elementi. Mendeleev ha combinato l'ordine del peso atomico con valenze comuni per organizzare gli elementi in una tabella. Cioè, ha organizzato gli elementi in gruppi in base alle loro caratteristiche chimiche. Poiché tali proprietà si ripetono ogni tanto, il risultato era una tabella periodica in cui ogni colonna verticale, chiamata gruppo, contiene elementi con caratteristiche simili e ogni riga orizzontale, chiamata punto, organizza gli elementi in base al peso, aumentando da sinistra a destra e dall'alto verso il basso.
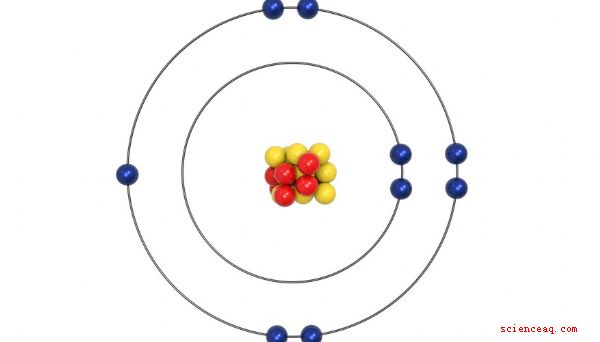
Struttura atomica
Circa 50 anni dopo la prima tavola periodica di Mendeleev, gli scienziati hanno scoperto che l'atomo è stato costruito attorno a un nucleo con protoni caricati positivamente e neutroni neutri, entrambi relativamente pesanti. Il nucleo carico positivamente è circondato da una nuvola di elettroni caricati negativamente. Il numero di protoni - chiamato anche numero atomico - corrisponde in genere al numero di elettroni. Si scopre che il numero di elettroni che un elemento ha in gran parte determina le sue proprietà chimiche. Quindi l'ordine corretto nella tavola periodica è determinato dal numero di elettroni, non dal peso come inizialmente proposto da Mendeleev.
Elettroni di valenza
Gli elettroni nella nuvola che circonda il nucleo di un elemento sono disposti in strati, chiamati gusci . Ogni shell ha un numero specifico di elettroni che può contenere. Quando ogni shell viene riempita, viene aggiunta una nuova shell fino a quando tutti gli elettroni non vengono calcolati. Gli elettroni nel guscio più esterno sono chiamati elettroni di valenza, perché sono le loro interazioni che determinano le proprietà chimiche di un elemento. Le colonne create per raggruppare gli elementi con proprietà chimiche simili risultano essere esattamente le stesse colonne definite dal numero di elettroni di valenza. Gli elementi nel gruppo 1A hanno un solo elettrone di valenza e ogni colonna del gruppo A a destra aggiunge un altro elettrone di valenza. L'organizzazione diventa un po 'confusa con gli elementi del Gruppo B, ma ognuno di essi è anche raggruppato per il loro numero di elettroni di valenza.