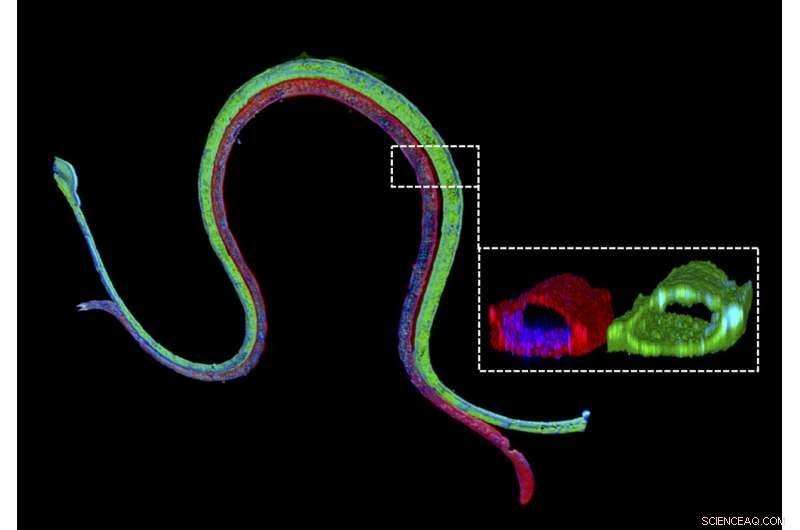
Colorazione di immunofluorescenza di un tubulo prossimale vascolarizzato biostampato in 3D con un marker epiteliale del tubulo prossimale colorato in verde nel canale del tubulo prossimale e un marker endoteliale vascolare colorato in rosso nel canale vascolare adiacente. La sezione trasversale ingrandita illustra che i due diversi tipi di cellule formano strutture perfusibili luminali nei rispettivi canali. Credito:Wyss Institute presso l'Università di Harvard
Ogni giorno i nostri reni affrontano l'arduo compito di pulire continuamente il nostro sangue per evitare sprechi, sale e liquidi in eccesso si accumulano all'interno del nostro corpo. Per realizzare questo, i circa un milione di unità di filtrazione dei reni (glomeruli) prima rimuovono sia i prodotti di scarto che i preziosi nutrienti dal flusso sanguigno, quindi strutture specializzate note come tubuli prossimali riassorbono le molecole "buone" restituendole al nostro flusso sanguigno. Mentre le funzioni di riassorbimento del tubulo prossimale possono essere compromesse dai farmaci, sostanze chimiche, o malattie genetiche e trasmissibili per via ematica, la nostra comprensione di come si verificano questi effetti è ancora limitata.
Per consentire lo studio del riassorbimento renale al di fuori del corpo umano, Jennifer Lewis, membro della facoltà principale del Wyss Institute, Sc.D., e il suo team che lavora all'interno della 3-D Organ Engineering Initiative del Wyss Institute di cui è co-direttore, e in collaborazione con il Roche Innovation Center Basel in Svizzera, ha creato un modello di tubulo prossimale vascolarizzato 3D in cui tubuli e vasi sanguigni perfusibili in modo indipendente sono stampati adiacenti l'uno all'altro all'interno di una matrice extracellulare ingegnerizzata. Questo lavoro si basa su un modello di tubulo prossimale 3-D continuamente perfuso segnalato in precedenza dal team che mancava ancora di un compartimento dei vasi sanguigni funzionale. Utilizzando il loro dispositivo di nuova generazione, il team ha misurato il trasporto di glucosio dal tubulo prossimale ai vasi sanguigni, insieme agli effetti dell'iperglicemia, una condizione associata al diabete nei pazienti. Il loro studio è pubblicato su Atti dell'Accademia Nazionale delle Scienze ( PNAS ).
Lewis è anche Hansjörg Wyss Professor of Biologically Inspired Engineering presso la Harvard John A. Paulson School of Engineering and Applied Science (SEAS), il Jianmin Yu Professor of Arts and Sciences e membro dell'Harvard Stem Cell Institute.
"Costruiamo questi dispositivi renali viventi in pochi giorni e possono rimanere stabili e funzionali per mesi, " ha detto il primo autore Neil Lin, dottorato di ricerca, che è un Roche Fellow e Postdoctoral Fellow nella squadra di Lewis. "È importante che questi tubuli prossimali vascolarizzati 3-D mostrano le morfologie delle cellule epiteliali ed endoteliali e le architetture luminali desiderate, così come l'espressione e la corretta localizzazione delle principali proteine strutturali e di trasporto, e fattori che consentono ai compartimenti tubulari e vascolari di comunicare tra loro".
Come primo passo verso la sperimentazione di farmaci e la modellizzazione delle malattie, il team ha indotto "iperglicemia", una condizione di alto livello di glucosio tipica del diabete e un noto fattore di rischio per le malattie vascolari, nel loro modello facendo circolare una concentrazione di glucosio quattro volte superiore alla normale attraverso il compartimento del tubulo prossimale. "Abbiamo scoperto che alti livelli di glucosio trasportati alle cellule endoteliali nel compartimento vascolare hanno causato danni alle cellule, " ha detto Kimberly Homan, dottorato di ricerca, un coautore dello studio e ricercatore associato nel gruppo di Lewis presso il Wyss Institute e SEAS. "Facendo circolare un farmaco attraverso il tubulo che inibisce specificamente un importante trasportatore di glucosio nelle cellule epiteliali del tubulo prossimale, abbiamo impedito che questi cambiamenti dannosi si verificassero alle cellule endoteliali nei vasi adiacenti".
L'obiettivo immediato del team è quello di ampliare ulteriormente questi modelli per l'uso in applicazioni farmaceutiche. "Il nostro sistema potrebbe consentire lo screening di librerie di farmaci mirate per la tossicità renale e quindi aiutare a ridurre gli esperimenti sugli animali, "ha detto Annie Moisan, dottorato di ricerca, un coautore e collaboratore industriale dello studio, e Principal Scientist presso il Roche Innovation Center Basel. "Sono entusiasta dei continui sforzi da parte nostra e di altri per aumentare la rilevanza fisiologica di tali modelli, ad esempio incorporando cellule malate e specifiche del paziente, poiché l'efficacia e la sicurezza personalizzate sono gli obiettivi finali della previsione delle risposte cliniche ai farmaci".
"Il nostro nuovo modello di rene 3D è un progresso entusiasmante in quanto ricapitola in modo più completo i segmenti del tubulo prossimale trovati nel tessuto renale nativo, " ha detto Lewis. "Oltre alle sue applicazioni immediate per lo screening dei farmaci e la modellazione delle malattie, stiamo anche valutando se questi dispositivi viventi possono essere utilizzati per aumentare la dialisi renale." Attualmente, le macchine salvavita per la dialisi filtrano il sangue, ma non sono in grado di recuperare preziose sostanze nutritive e altre specie dal filtrato di cui il corpo ha bisogno per molte delle sue funzioni, che possono causare carenze e complicazioni specifiche lungo la linea. Lewis and her colleagues believe that 3-D bioprinted vascularized tubules may lead to improved renal replacement therapies.
"This study presents a significant step forward in human kidney engineering that enables human disease and drug-related studies to be carried out over extended periods of time in vitro. It also represents a major step forward for the Wyss Institute's 3-D Organ Engineering Initiative, which aims to generate functional organ replacements with enhanced functionalities for patients in need, ", ha affermato il direttore fondatore del Wyss Institute, Donald Ingber, M.D., dottorato di ricerca, che è anche Judah Folkman Professor of Vascular Biology presso HMS e Vascular Biology Program presso il Boston Children's Hospital, nonché Professore di Bioingegneria presso SEAS.