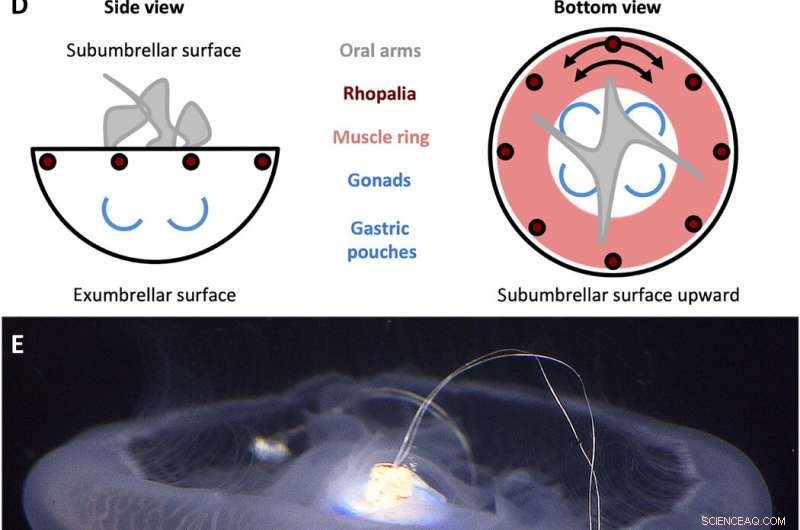
Design del controller di nuoto A. aurita. (A) Segnale ad onda quadra generato dal controller di nuoto con un'ampiezza (A) di 3,7 V e un'ampiezza dell'impulso (T) di 10 ms, fissato a frequenze (f) di 0,25, 0,38, 0,50, 0,62, 0,75, 0,88, e 1,00Hz. (B) Componenti del controller di nuoto. L'alloggiamento include (i) un cappuccio in polipropilene con un perno di legno che si inserisce nel centro della campana, e (ii) una pellicola di plastica per impermeabilizzare l'alloggiamento, entrambi sfalsati con pesi in acciaio inossidabile e sughero per mantenere il dispositivo a galleggiamento approssimativamente neutro. La microelettronica include (iii) un mini-processore TinyLily, (iv) batteria ai polimeri di litio, e (v) due elettrodi con punta in platino con LED per indicare visivamente la stimolazione. (C) Dispositivo completamente assemblato, con il processore e la batteria racchiusi nell'alloggiamento. (D) Schemi semplificati dell'anatomia di A. aurita, evidenziando le superfici subumbrellar (in alto) ed exumbrellar (in basso), ropalia, anello muscolare, e l'orientamento circonferenziale delle fibre muscolari, braccia orali, e gonadi/sacche gastriche. (E) Controller di nuoto (inattivo) incorporato in una medusa che nuota liberamente, lato subumbrellar orientato a campana verso l'alto, con il perno di legno inserito nel manubrio e due elettrodi incorporati nel muscolo e nel tessuto mesogleale vicino al margine della campana. Crediti fotografici per (B), (C), e (E):Nicole W. Xu, Università di Stanford. Credito:progressi scientifici, doi:10.1126/sciadv.aaz3194
I ricercatori in materiali robotici mirano a controllare artificialmente la locomozione animale per affrontare le sfide esistenti all'attuazione, controllo e requisiti di alimentazione nella robotica morbida. In un nuovo rapporto in Progressi scientifici , Nicole W. Xu e John O. Dabiri presso i dipartimenti di bioingegneria, ingegneria civile e ambientale e ingegneria meccanica presso la Stanford University hanno presentato un robot bioibrido che utilizzava la microelettronica di bordo per indurre il nuoto nelle meduse vive. Hanno misurato la capacità di migliorare sostanzialmente la propulsione guidando le contrazioni del corpo a una gamma di frequenza ottimale più velocemente del comportamento naturale. La manovra ha aumentato la velocità di nuoto di quasi tre volte, sebbene con solo un doppio aumento del dispendio metabolico dell'animale e 10 mW di potenza esterna in ingresso alla microelettronica. Il robot bioibrido ha utilizzato da 10 a 1000 volte meno energia esterna per massa rispetto ai robot acquatici segnalati in precedenza. La capacità può migliorare la portata delle prestazioni dei robot bioibridi rispetto alle prestazioni native, con potenziali applicazioni come robot di monitoraggio oceanico bioibridi.
Le meduse sono un organismo modello convincente per formare veicoli sottomarini ad alta efficienza energetica grazie al loro basso costo di trasporto (COT). I robot biomimetici esistenti di animali che nuotano, costruiti interamente con materiali ingegnerizzati, possono raggiungere velocità paragonabili a quelle degli animali naturali, ma con ordini di grandezza meno efficienti delle meduse. I robot meduse bioibridi possono quindi integrare animali vivi per affrontare le sfide esistenti della robotica morbida. I ricercatori possono utilizzare la struttura della medusa per l'attuazione e risolvere i requisiti di alimentazione esplorando i comportamenti naturali di alimentazione in cui estraggono energia chimica dalla preda in situ. L'approccio può anche consentire il recupero dal danno attraverso processi naturali di guarigione delle ferite inerenti all'animale, controllare la locomozione animale e consentire ulteriori studi sulla biomeccanica degli organismi vivi in esperimenti controllati dall'utente. In questo studio, Xu e Dabiri hanno utilizzato un sistema di microelettronica per controllare esternamente una medusa viva e formare un robot bioibrido per far progredire la scienza e l'ingegneria della locomozione acquatica.
Per attivare le meduse come impalcature naturali, il team ha utilizzato il metabolismo basale dell'animale per ridurre i requisiti energetici aggiuntivi e ha sfruttato i suoi muscoli per l'attivazione, facendo affidamento sulle proprietà di autoguarigione e di rigenerazione dei tessuti per una maggiore tolleranza ai danni. Il team ha ipotizzato che l'aumento delle frequenze di contrazione della campana delle meduse potrebbe aumentare la velocità di nuoto fino a un limite. Hanno quindi controllato esternamente la frequenza degli impulsi negli animali che nuotano liberamente misurando la velocità di nuoto e l'assunzione di ossigeno per calcolare il costo del trasporto (COT) e testare la loro ipotesi di lavoro. In precedenza tali esami erano possibili solo attraverso modelli computazionali o teorici.
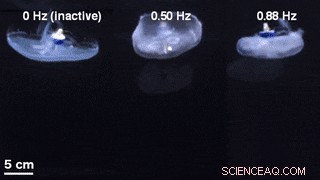
Un confronto delle geometrie della campana per il nuoto non stimolato con un controller di nuoto inattivo incorporato (a sinistra) e il nuoto controllato esternamente a 0,50 Hz (al centro) e 0,88 Hz (a destra). Credito:progressi scientifici, doi:10.1126/sciadv.aaz3194
Xu et al. selezionato Aurelia aurita come organismo modello; una specie oblata di medusa contenente una campana mesogleale flessibile e un monostrato di muscoli coronali e radiali che rivestono la superficie subombrello. Per nuotare, gli organismi hanno contratto i muscoli per ridurre il volume della cavità subombrellone ed espellere l'acqua per fornire una forza motrice insieme a contributi aggiuntivi dalla ripresa passiva dell'energia e dalla propulsione basata sull'aspirazione. Per iniziare queste contrazioni muscolari, la medusa ha attivato uno dei suoi pacemaker leggeri situati negli organi sensori noti come rhopalia lungo il margine della campana. Questi cluster nervosi hanno attivato l'intera rete nervosa motoria per causare propagazioni di onde muscolari bidirezionali originate dai pacemaker attivati durante la propagazione naturale.
Integrazione della progettazione robotica in meduse vive e convalida del dispositivo
Gli scienziati hanno prima progettato un portatile, controller di nuoto microelettronico autonomo per generare un'onda pulsata quadra e stimolare le contrazioni muscolari da 0,25 Hz a 1,00 Hz. Hanno composto il controller con un mini-processore TinyLily e una cella ai polimeri di litio da 10 mAh. Per confermare visivamente il segnale elettrico, Xu et al. collegato i fili in serie ai diodi emettitori di luce TinyLily (LED). Hanno quindi inserito gli elettrodi bilateralmente nel tessuto subombrellone e hanno mantenuto il sistema galleggiante in modo naturale con rondelle in acciaio inossidabile e sughero. Per verificare che il controller di nuoto possa controllare esternamente le contrazioni della campana delle meduse, gli scienziati hanno sviluppato un metodo per tracciare il movimento del margine della campana. Per questo, hanno completato tre serie di esperimenti, (1) osservare le contrazioni endogene dell'organismo in assenza di disturbi, (2) per osservare se l'inclusione meccanica di elettrodi inattivi ha influenzato il comportamento naturale degli animali e (3) per testare i protocolli di stimolazione per confermare le contrazioni guidate dall'esterno.
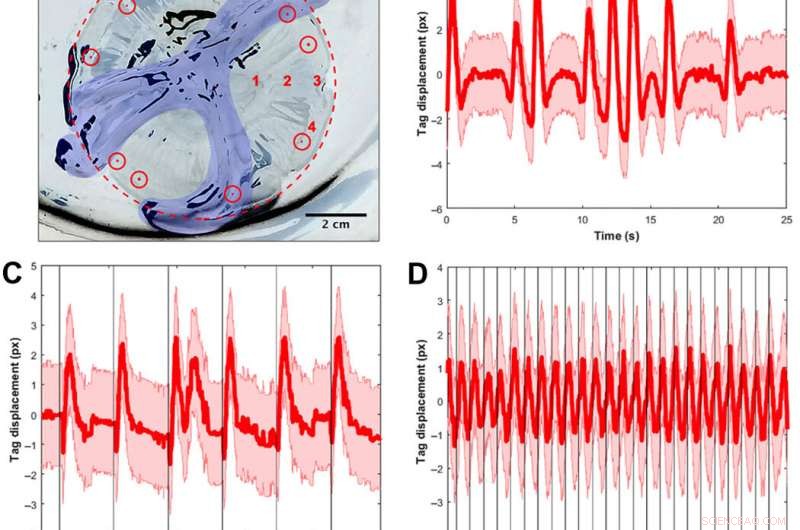
Convalida del segnale utilizzando tag visivi e spettri di frequenza per monitorare le contrazioni muscolari. (A) A. aurita medusae (n =10, da 8,0 a 10,0 cm di diametro) sono stati posizionati sulla superficie dell'ombrellone in una piastra senza acqua di mare per esperimenti di stimolazione muscolare vincolata (elettrodo non mostrato). L'immagine è invertita in modo che la campana e il piatto siano bianchi, e le aree nere sono riflessi di luce dal tessuto animale e dal piatto. Per chiarezza, il margine della campana è delineato in un cerchio rosso punteggiato, e le braccia orali sono colorate in blu. Le etichette visibili dell'elastomero dell'impianto (mostrate come punti rossi colorati all'interno di cerchi rossi) sono state iniettate attorno al margine, e un tag è stato tracciato per video per calcolare lo spostamento del tessuto come surrogato delle contrazioni muscolari. I test spaziali per determinare se la posizione dell'elettrodo ha influenzato gli spettri sono stati condotti in quattro posizioni, etichettato in numeri rossi:(1) adiacente alle tasche gastriche, (2) a metà strada tra le tasche gastriche e il margine, (3) alla rhopalia, e (4) al margine lontano dalla rhopalia. Tutti gli altri test sono stati condotti nella posizione 2. (B) Esempio di spostamento del tag in funzione del tempo per un animale senza alcuno stimolo esterno. La linea rossa indica lo spostamento del baricentro, con l'errore calcolato assumendo un'incertezza di mezzo pixel nel trovare il centroide del tag in ciascuna immagine, oltre 25 s. Notare la variazione temporale delle contrazioni muscolari, compresi periodi di impulsi regolari e successivi impulsi rapidi. (C) Esempio di spostamento del tag per un animale con uno stimolo esterno di 0,25 Hz, con ogni stimolo visualizzato come una linea nera verticale. Sebbene le contrazioni seguano regolarmente stimoli esterni, gli impulsi naturali degli animali si verificano anche a basse frequenze. Nota, Per esempio, il doppio impulso dopo uno stimolo (t ≈ 12 s). (D) Esempio di spostamento del tag per un animale con uno stimolo esterno di 1,00 Hz, con ogni stimolo visualizzato come una linea nera verticale. Viene mostrata la stessa finestra temporale (25 s) per un confronto equo con i due grafici precedenti. Le contrazioni seguono regolarmente gli stimoli esterni. (E) spettro di ampiezza unilaterale (SSAS) mediato per meduse senza alcuno stimolo esterno (n =12 per 10 animali, cioè., 2 meduse avevano due clip replicate ciascuna). La linea rossa indica la media di SSAS normalizzato per ogni replica, con la SD in rosa. Il picco della SSAS media è a 0,16 Hz. L'intera larghezza a metà del massimo (FWHM) è 0,24 Hz. (F) Risposta delle meduse a un elettrodo inattivo incorporato (n =14 per 10 animali, cioè., 4 meduse avevano due clip replicate ciascuna). Il picco della SSAS media è a 0,18 Hz. Il FWHM è 0,16 Hz. Utilizzando un test t a due campioni delle frequenze di picco per entrambi i gruppi, la differenza tra i due campioni era statisticamente insignificante (P =0,68). (G) Campione SSAS per uno stimolo elettrico a 1,00 Hz (n =10 meduse per un segnale di ingresso di 4,2 V e 4,0 ms). La frequenza di picco si verifica a 1,02 Hz, all'interno della finestra 0.02 utilizzata per calcolare SSAS. Si noti che lo spettro ha un picco più acuto alla frequenza di interesse (FWHM di 0,04 Hz), rispetto a un FWHM più ampio in (B) e (C), i casi senza alcuno stimolo esterno. (H) Mappa dei contorni della risposta in frequenza delle contrazioni muscolari agli stimoli elettrici esterni. Ogni linea verticale di dati (centrata su linee bianche a 0,25, 0,50, 0,75, 1.00, 1.20, 1,50, e 2,00 Hz) rappresenta il PSD a una frequenza di ingresso elettrico, con il numero di meduse testate mostrato sopra. I colori corrispondono all'ampiezza del PSD, in cui i valori più alti sono mostrati in giallo e quelli più bassi in blu. La linea rossa continua rappresenta una risposta input-output uno a uno, e la linea rossa tratteggiata rappresenta il limite fisiologico riportato secondo il periodo refrattario assoluto minimo del muscolo A. aurita (32). Le prove reattive sono definite dal fatto che le frequenze di picco nel PSD si trovino all'interno di una finestra di 0,06 Hz della curva rossa continua. (I) Mappe di contorno delle prove non responsivi. Anche le frequenze più alte fino a 90,00 Hz sono state testate con PSD simili che non rispondono. Credito fotografico per (A):Nicole W. Xu, Università di Stanford. Credito:progressi scientifici, doi:10.1126/sciadv.aaz3194
Hanno scoperto che il comportamento naturale degli animali (o la contrazione endogena) era irregolare con un'elevata variabilità della frequenza del polso, inclusa una frequenza di picco media di 0,16 Hz. Un elettrodo inattivo non ha modificato significativamente gli spettri di frequenza, mentre le contrazioni guidate dall'esterno hanno mostrato un limite fisiologico delle contrazioni muscolari delle meduse tra 1,4 Hz e 1,5 Hz. Il team ha condotto prove di nuoto con il sistema impiantato in una vasca di acqua salata e ha normalizzato le velocità di nuoto misurate per tenere conto della variazione delle dimensioni degli animali. Hanno ridimensionato la velocità di nuoto normalizzata mediante la media della velocità normalizzata in assenza di stimolazione (cioè 0 Hz) per determinare il fattore di miglioramento. Il fattore di miglioramento massimo era fino a 2,8 volte la velocità naturale di nuoto degli animali, cioè., la velocità di nuoto è aumentata fino a 2,8 volte utilizzando la microelettronica di bordo.
Consumo energetico del dispositivo altamente efficiente
La medusa controllata artificialmente richiedeva energia esterna dal sistema microelettronico e energia interna dal metabolismo degli animali. Quando guidato a frequenze crescenti, il sistema microelettronico della medusa robotica bioibrida consumava maggiori Watt per kg. Però, rispetto ai robot esistenti, questo robot bioibrido utilizzava fino a 1000 volte meno energia esterna. Xu et al. ha confrontato questo prototipo con il raggio medusoide e robotico realizzato da cardiomiociti di ratto seminati su impalcature di silicio, e con robot puramente meccanici e veicoli subacquei autonomi (AUV). Oltre ai vantaggi economici del basso consumo energetico esterno per massa del robot bioibrido, il sistema microelettronico costa solo meno di $ 20 dai componenti disponibili in commercio. Anche l'elettrolocalizzazione era aspecifica e gli animali si sono immediatamente ripresi dopo gli esperimenti.
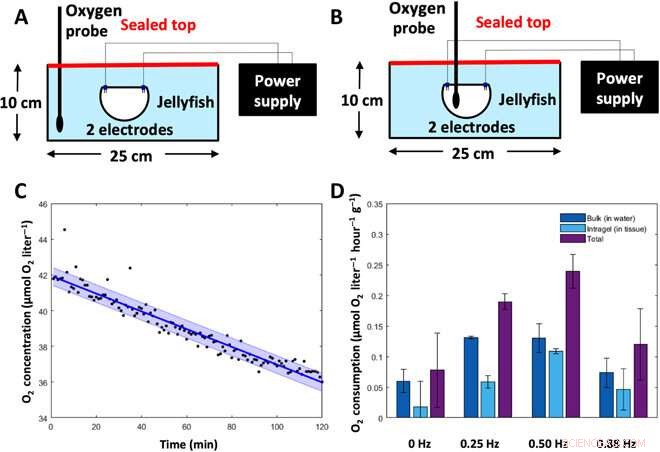
Metabolic rate experiments. To determine the metabolic rate of jellyfish, oxygen concentrations were measured in animal tissue and the surrounding water and then converted into energy expenditure. (A) Experimental setup to measure bulk dissolved oxygen concentrations (in the water). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Oxygen levels in the water were measured using a MicroOptode oxygen probe. (B) Experimental setup to measure intragel oxygen concentrations (in the tissue). Animals were placed subumbrellar surface upward in a sealed glass dish filled with 2 liters of artificial seawater, with two electrodes for frequency-driven cases. Intragel oxygen levels were measured using a MicroOptode oxygen probe embedded into the tissue. (C) Representative plot of oxygen concentrations over time, measured from the MicroOptode. This example shows measurements of bulk oxygen levels in the water surrounding an animal with a swim controller–driven frequency of 1.00 Hz. Individual data points are shown in black, the best-fit line is shown in dark blue, and the SD is shown in the light blue shaded region. (D) Oxygen consumption rates of the surrounding water (dark blue), within animal tissue (light blue), and total (sum of the water and tissue measurements, purple) were calculated over a 6- to 8-hour period (n =7 animals).Credit:Science Advances, doi:10.1126/sciadv.aaz3194
The new capability of external control allowed Xu et al. to address the relationship between swimming frequency and metabolic rate. Oxygen consumption rates followed a similar pattern to enhanced swimming speeds, and the scientists calculated the equivalent cost of transport using both experimental metabolic rates and experimental swimming speeds. The COT increased at mid-range frequencies and decreased at high external stimulation frequencies. The results showed that enhanced jellyfish swimming did not cause undue cost to the metabolism or health of the animal.
The main robotic limit of the study was the power requirement of the microelectronic system relative to animal versus microelectronic power needs. Further improvement to microelectronics can decrease the energetic costs and extended studies can also strive to minimize endogenous animal contractions without harming the organism to improve controllability of live-animal-based biohybrid robots. The artificial control of jellyfish can expand ocean monitoring techniques with improved controllability by incorporating microelectronic sensors to leverage the existing tagging technology.
© 2020 Scienza X Rete