Gli atomi sono i "mattoni della materia". Tutto ciò che ha massa e occupa spazio (avendo volume) è costituito da queste minuscole unità. Questo vale per l'aria che respiri, l'acqua che bevi e il tuo stesso corpo.
Gli isotopi sono un concetto vitale nello studio degli atomi. chimici, fisici e geologi li usano per dare un senso al nostro mondo. Ma prima di poter spiegare cosa sono gli isotopi, o perché sono così importanti, dovremo fare un passo indietro e considerare gli atomi nel loro insieme.
Come probabilmente sai, gli atomi hanno tre componenti principali, due dei quali risiedono nel nucleo. Situato al centro dell'atomo, il nucleo è un ammasso fitto di particelle. Alcune di queste particelle sono protoni, che hanno cariche elettriche positive.
È ben documentato che le cariche opposte si attraggono. Nel frattempo, corpi con carica simile tendono a respingersi l'un l'altro. Quindi ecco una domanda:come possono coesistere due o più protoni, con le loro cariche positive, nello stesso nucleo? Non dovrebbero allontanarsi a vicenda?
È qui che entrano in gioco i neutroni. I neutroni sono particelle subatomiche che condividono i nuclei con i protoni. Ma i neutroni non possiedono una carica elettrica. Fedele al loro nome, i neutroni sono neutri, non essendo né positivamente né negativamente caricata. È un attributo importante. In virtù della loro neutralità, i neutroni possono impedire ai protoni di spingersi l'un l'altro fuori dal nucleo.
In orbita attorno al nucleo ci sono gli elettroni, particelle ultraleggere con cariche negative. Gli elettroni facilitano il legame chimico e i loro movimenti possono produrre una piccola cosa chiamata elettricità. I protoni non sono meno importanti. Per una cosa, aiutano gli scienziati a distinguere gli elementi.
Potresti aver notato che nella maggior parte delle versioni della tavola periodica, ogni quadrato ha un piccolo numero stampato nell'angolo in alto a destra. Quella cifra è conosciuta come il numero atomico. Dice al lettore quanti protoni ci sono nel nucleo atomico di un dato elemento. Per esempio, il numero atomico dell'ossigeno è otto. Ogni atomo di ossigeno nell'universo ha un nucleo con esattamente otto protoni; non più, non di meno.
Senza questa disposizione molto specifica delle particelle, l'ossigeno non sarebbe ossigeno. Il numero atomico di ogni elemento, compreso quello dell'ossigeno, è totalmente unico. Ed è un tratto distintivo. Nessun altro elemento ha otto protoni per nucleo. Contando i protoni, puoi identificare un atomo. Proprio come gli atomi di ossigeno avranno sempre otto protoni, gli atomi di azoto vengono invariabilmente con sette. È così semplice.
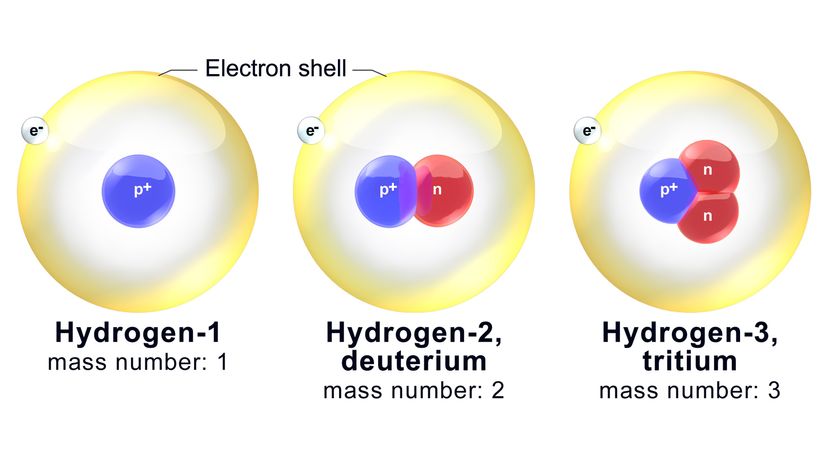
I neutroni non seguono l'esempio. Il nucleo in un atomo di ossigeno è garantito per ospitare otto protoni (come abbiamo stabilito). Però, potrebbe anche contenere da quattro a 20 neutroni. Gli isotopi sono varianti dello stesso elemento chimico che hanno un diverso numero di neutroni.
Ora, ogni isotopo è nominato in base al suo numero di massa, che è il numero totale combinato di neutroni e protoni in un atomo. Per esempio, uno degli isotopi dell'ossigeno più conosciuti è chiamato ossigeno-18 (O-18). Ha gli otto protoni standard più 10 neutroni.
Quindi, il numero di massa di O-18 è - hai indovinato - 18. Un isotopo correlato, ossigeno-17 (O-17), ha un neutrone in meno nel nucleo.
Alcune combinazioni sono più forti di altre. Gli scienziati classificano O-17 e O-18 come isotopi stabili. In un isotopo stabile, le forze esercitate dai protoni e dai neutroni si tengono insieme, mantenendo intatto il nucleo in modo permanente.
Il rovescio della medaglia, i nuclei negli isotopi radioattivi, chiamati anche "radioisotopi, " sono instabili e decadranno nel tempo. Queste cose hanno un rapporto protone-neutrone che è fondamentalmente insostenibile a lungo termine. Nessuno vuole rimanere in quella situazione. Quindi, isotopi radioattivi elimineranno alcune particelle subatomiche (e rilasceranno energia) fino a quando non si saranno convertiti in belle, isotopi stabili.
O-18 è stabile, ma l'ossigeno-19 (O-19) non lo è. Quest'ultimo si romperà inevitabilmente, in fretta! Entro 26,88 secondi dalla sua creazione, un campione di O-19 è garantito per perdere metà dei suoi atomi a causa delle devastazioni del decadimento.
Ciò significa che O-19 ha un'emivita di 26,88 secondi. Un'emivita è la quantità di tempo che impiega il 50 percento di un campione di isotopo a decadere. Ricorda questo concetto; lo collegheremo alla paleontologia nella prossima sezione.
Ma prima di parlare di scienza fossile, c'è un punto importante che deve essere fatto. A differenza dell'ossigeno, alcuni elementi non hanno isotopi stabili di sorta. Considera l'uranio. Nel mondo naturale ci sono tre isotopi di questo metallo pesante, e sono tutti radioattivi, con i nuclei atomici in costante stato di decadimento. Infine, un pezzo di uranio si trasformerà in un elemento completamente diverso.
Non preoccuparti di provare a guardare la transizione in tempo reale. Il processo si svolge molto, molto lentamente.
Uranio-238 (U-238), l'isotopo più comune dell'elemento, ha un'emivita di circa 4,5 miliardi di anni! Gradualmente, diventerà piombo-206 (Pb-206), che è stabile. Allo stesso modo, l'uranio-235 (U-235) - con la sua emivita di 704 milioni di anni - passa al piombo-207 (Pb-207), un altro isotopo stabile.
Ai geologi, queste sono informazioni davvero utili. Supponiamo che qualcuno trovi una lastra di roccia i cui cristalli di zircone contengono una miscela di U-235 e Pb-207. Il rapporto tra questi due atomi può aiutare gli scienziati a determinare l'età della roccia.
Ecco come:diciamo che gli atomi di piombo superano di gran lunga le loro controparti di uranio. In quel caso, sai che stai guardando una roccia piuttosto vecchia. Dopotutto, l'uranio ha avuto tutto il tempo per iniziare a trasformarsi in piombo. D'altra parte, se è vero il contrario - e gli atomi di uranio sono più comuni - allora la roccia deve essere sul lato più giovane.
La tecnica che abbiamo appena descritto si chiama datazione radiometrica. Questo è l'atto di utilizzare i tassi di decadimento ben documentati degli isotopi instabili per stimare l'età dei campioni di roccia e delle formazioni geologiche. I paleontologi sfruttano questa strategia per determinare quanto tempo è trascorso dal deposito di un particolare fossile. (Anche se non è sempre possibile datare direttamente l'esemplare.)
Non è necessario essere un appassionato di preistoria per apprezzare gli isotopi. I medici usano alcune delle varietà radioattive per monitorare il flusso sanguigno, studiare la crescita ossea e persino combattere il cancro. I radioisotopi sono stati utilizzati anche per fornire agli agricoltori informazioni sulla qualità del suolo.
Così il gioco è fatto. Qualcosa di apparentemente astratto come la variabilità dei neutroni influenza tutto, dalla cura del cancro ai misteri del tempo profondo. La scienza è fantastica.
ORA È DIVERTENTESport e scienza si incrociano più spesso di quanto si pensi. La più grande città del New Mexico ha fondato una nuova squadra di baseball di minor league nel 2003. Il suo nome? Gli isotopi di Albuquerque. Un riferimento a un episodio della stagione 12 de "I Simpson, " il nome insolito della squadra ha avuto un piacevole effetto collaterale:per necessità, i dipendenti del campo da baseball distribuiscono regolarmente lezioni di chimica ai fan curiosi.