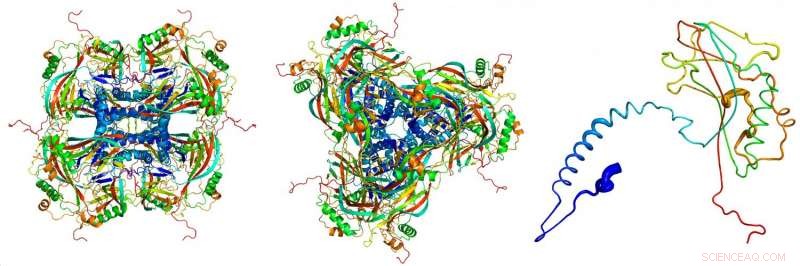
Modello atomico dei corpi di occlusione cristallina, derivato dalle immagini di diffrazione dei raggi X registrate presso il laser a elettroni liberi a raggi X LCLS presso lo SLAC National Accelerator Laboratory. Le singole proteine (a destra) si uniscono per formare i mattoni (a sinistra, visto di lato; centro, visto dall'alto) dei corpi occlusivi cristallini. Credito:Dominik Oberthuer, CFEL/DESY
Un team internazionale di scienziati ha utilizzato impulsi a raggi X ad alta intensità per determinare la struttura dell'involucro proteico cristallino di un virus di insetto. La loro analisi rivela i dettagli fini dei mattoni che compongono il bozzolo virale fino a una scala di 0,2 nanometri (milionesimi di millimetro) - che si avvicina alla risoluzione della scala dell'atomo. I minuscoli virus con il loro involucro di cristallo sono di gran lunga i più piccoli cristalli proteici mai analizzati utilizzando la cristallografia a raggi X. Questo apre nuove opportunità nello studio delle strutture proteiche, come riporta il team guidato dal Leading Scientist di DESY Henry Chapman del Center for Free-Electron Laser Science nel Atti dell'Accademia Nazionale delle Scienze ( PNAS ).
"Il granulovirus attacca alcuni insetti e li uccide. Questo inizialmente lo lascia bloccato all'interno dell'ospite in decomposizione, quindi deve proteggersi, forse per anni, contro condizioni ambientali avverse come il calore, radiazioni ultraviolette e siccità, finché non viene nuovamente ingerito da un insetto. Per realizzare questo, il virus si avvolge in un bozzolo fatto di cristalli proteici, che si dissolve di nuovo solo quando raggiunge l'intestino di un insetto, " spiega Cornelius Gati di DESY, l'autore principale del saggio. Questi virus sono un particolare interesse di Peter Metcalf dell'Università di Auckland in Nuova Zelanda e Johannes Jehle del Julius Kühn Institute di Darmstadt, che ha collaborato con DESY per questa ricerca. I ricercatori hanno esaminato il bozzolo del Cydia pomonella granulovirus (CpGV), che infetta i bruchi della carpocapsa ( Cydia pomonella ) ed è utilizzato in agricoltura come pesticida biologico. Il virus è innocuo per l'uomo.
Gli scienziati sono interessati alla struttura spaziale delle proteine e di altre biomolecole perché questo fa luce sul modo preciso in cui funzionano. Ciò ha portato a una scienza specializzata nota come biologia strutturale. "Negli ultimi 50 anni, gli scienziati hanno determinato le strutture di più di 100, 000 proteine, "dice Chapman, che è anche professore di fisica all'Università di Amburgo. "Lo strumento di gran lunga più importante per questo è la cristallografia a raggi X". In questo metodo, un cristallo della proteina in esame viene coltivato e irradiato con raggi X luminosi. Questo produce un caratteristico schema di diffrazione, da cui è possibile calcolare la struttura spaziale del cristallo e dei suoi mattoni.
"Una delle grandi sfide di questa procedura è, però, crescere i cristalli, " aggiunge Chapman. Molte proteine non si allineano facilmente per formare cristalli, perché quello non è il loro stato naturale. Più piccoli sono i cristalli che possono essere utilizzati per l'analisi, più è facile coltivarli, ma più è difficile misurarli. "Speriamo che in futuro saremo in grado di fare a meno della crescita dei cristalli e studiare le singole molecole direttamente usando i raggi X, "dice Chapman, "quindi vorremmo capire i limiti".
"Queste particelle virali ci hanno fornito i cristalli proteici più piccoli mai usati per l'analisi della struttura a raggi X, " spiega Gati. Il corpo di occlusione (il "bozzolo" del virus) ha un volume di circa 0,01 micrometri cubi, circa cento volte più piccoli dei più piccoli cristalli proteici cresciuti artificialmente che sono stati finora analizzati con tecniche cristallografiche.
Per rompere questo limite nella dimensione del cristallo, era necessario un fascio di raggi X estremamente luminoso, ottenuta utilizzando un cosiddetto laser ad elettroni liberi (FEL), in cui un fascio di elettroni ad alta velocità è guidato attraverso un ondulatore magnetico che li fa emettere impulsi a raggi X simili a laser.
Gli scienziati hanno utilizzato il laser a elettroni liberi LCLS presso lo SLAC National Accelerator Laboratory negli Stati Uniti, e ha impiegato l'ottica per focalizzare ogni impulso di raggi X su una dimensione simile a quella di una delle particelle del virus. "Dirigere l'intero potere del FEL su un minuscolo virus lo ha esposto ai tremendi livelli di radiazioni, " riferisce Gati, che ora lavora allo SLAC. La dose era di 1,3 miliardi di Grigi; per fare un confronto:la dose letale per l'uomo è di circa 50 Gray.
La dose FEL era certamente letale anche per i virus:ognuno era completamente vaporizzato da un singolo impulso a raggi X. Ma l'impulso della durata di femtosecondi porta le informazioni della struttura incontaminata al rivelatore e la distruzione del virus avviene solo dopo il passaggio dell'impulso. L'analisi della diffrazione registrata ha mostrato che anche minuscoli cristalli di proteine che vengono bombardati con dosi di radiazioni estremamente elevate possono ancora rivelare la loro struttura su scala atomica.
"Le simulazioni basate sulle nostre misurazioni suggeriscono che il nostro metodo può essere probabilmente utilizzato per determinare la struttura di cristalli ancora più piccoli costituiti da sole centinaia o migliaia di molecole, " riferisce Chapman, che è anche membro del Centro di Amburgo per l'imaging ultraveloce (CUI). "Questo ci porta un enorme passo avanti verso il nostro obiettivo di analizzare le singole molecole".