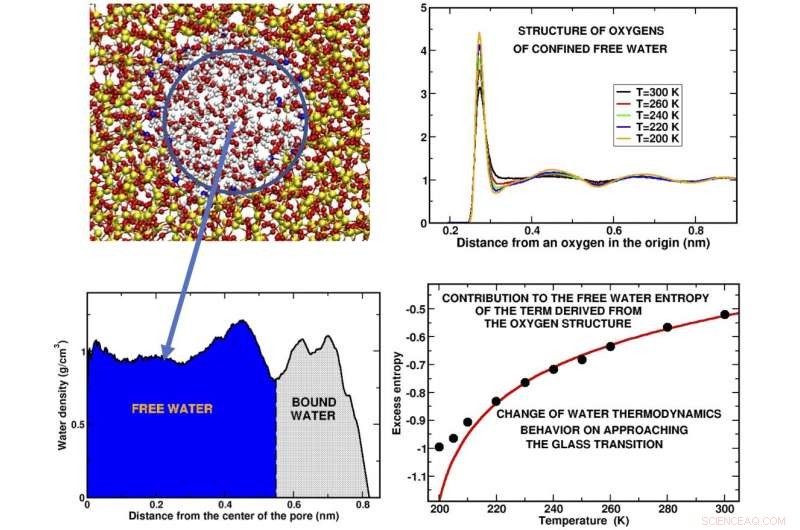
Pannello in alto a sinistra:istantanea di una fetta d'acqua confinata nel poro di silice. Il cerchio blu contiene l' acqua libera, ' le molecole d'acqua che non sono in contatto con il substrato. Pannello in basso a sinistra:profilo di densità delle molecole d'acqua lungo il raggio dei pori. Le regioni occupate rispettivamente dall'acqua libera e dall'"acqua legata, " acqua attaccata al substrato, sono indicati. Pannello in alto a destra:le curve rappresentano come gli atomi di ossigeno delle molecole sono disposti in gusci attorno a un dato atomo di ossigeno nell'origine a diverse temperature. I picchi rappresentano le posizioni in cui si trovano i diversi gusci. La struttura è mostrata per alcune delle temperature sovraraffreddate studiate. Pannello in basso a destra:Il risultato principale della nostra simulazione al computer è dato dal comportamento dell'entropia in eccesso, una frazione dell'entropia totale, ottenuto dalla struttura dell'ossigeno dell'acqua libera. La deviazione dei punti neri calcolati dalla curva teorica (rossa) indica che l'acqua subisce un cambiamento di comportamento prima e all'avvicinarsi della transizione vetrosa. Crediti:Margherita De Marzio, Gaia Camisasca, Maria Martin Conde, Mauro Rovere e Paola Gallo
Ci sono poche cose più centrali dell'acqua per la vita sulla terra. Domina il paesaggio fisico, coprendo gran parte del pianeta sotto forma di oceani. È anche un componente importante del corpo umano, comprendente, Per esempio, più del 70% della massa di un neonato.
Eppure, nonostante la sua onnipresenza, l'acqua ha molte proprietà fisiche che ancora non sono state completamente comprese dalla comunità scientifica. Uno dei più sconcertanti riguarda l'attività delle molecole d'acqua dopo che sono state sottoposte a un processo chiamato "sovraraffreddamento".
Ora, nuove scoperte dall'Università Roma Tre, A Roma, Italia, sulle interazioni delle molecole d'acqua in queste condizioni esotiche appaiono questa settimana nel Giornale di Fisica Chimica .
"Normalmente, quando l'acqua liquida viene raffreddata al di sotto del punto di congelamento, le molecole d'acqua si dispongono nell'ordine, struttura cristallina che è ghiaccio, " ha detto Paola Gallo, Professore Associato di Fisica presso l'Università degli Studi Roma Tre. "Con il superraffreddamento, vengono impiegate particolari tecniche per raffreddare l'acqua molto velocemente in modo tale che essa rimanga liquida anche se la sua temperatura è stata abbassata ben al di sotto del punto di congelamento. Ci sono una serie di anomalie nell'attività delle molecole d'acqua in queste condizioni super raffreddate che non sono state ancora completamente spiegate".
Utilizzando una simulazione al computer, Gallo e i suoi colleghi hanno fatto luce su una proprietà termodinamica dell'acqua che aiuta a spiegare come le molecole d'acqua in uno stato superraffreddato interagiscono tra loro e con le molecole di altri materiali.
"Mentre il superraffreddamento è un fenomeno importante da studiare, la sfida è che è molto difficile raffreddare l'acqua in un laboratorio, " disse Gallo.
Nel passato, scienziati hanno tentato di affrontare questo problema sottoraffreddando l'acqua "in confinamento, " concentrare gli sforzi sullo studio dell'acqua confinata in pori fabbricati aventi un raggio di pochi namometri (cioè uno o due ordini di grandezza maggiore del diametro della molecola d'acqua). Questo, però, ha sollevato la questione se le proprietà di quest'acqua confinata differiscano da quelle dell'acqua sfusa, dove le molecole d'acqua interagiscono liberamente in volumi maggiori.
"Questa domanda è stata un punto di interesse costante nel nostro lavoro, " ha detto Gallo. "In studi precedenti, abbiamo dimostrato che le interazioni con altre sostanze chimiche influenzano solo quelle molecole d'acqua che sono fisicamente molto vicine alle molecole di un'altra sostanza chimica, come le molecole che compongono la parete del poro. Le molecole d'acqua al centro del poro, l'acqua libera, conservano molte delle proprietà dell'acqua sfusa."
"Con questo studio, abbiamo scoperto che ci sono ulteriori parallelismi, Disse anche Gallo. la nostra simulazione mostra che una proprietà della struttura della rete di molecole d'acqua, che può essere misurato e verificato sperimentalmente, può essere utilizzato per determinare i cambiamenti nell'entropia dell'acqua, la quantità termodinamica che misura il disordine in un sistema [...] che può offrire spunti su alcuni degli aspetti termodinamici più insoliti dell'attività dell'acqua in questo stato super raffreddato."
Questi risultati creano una struttura per altri fisici sperimentali per ricreare la simulazione con campioni fisici in un laboratorio. Per Gallo e i suoi colleghi, il loro lavoro offre una base per ulteriori indagini sulle relazioni tra le caratteristiche termodinamiche delle acque confinate e sfuse.
"L'acqua è il liquido più importante che abbiamo sulla terra, " ha spiegato Gallo. "Qualsiasi intuizione che i ricercatori possono scoprire sulle sue proprietà può far avanzare non solo la nostra comprensione collettiva della fisica, ma anche di biologia e chimica, e aprono nuove possibilità per integrare questa conoscenza in diverse applicazioni tecnologiche."