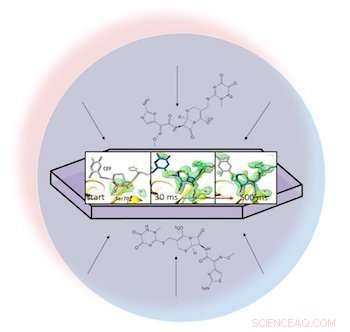
In una gocciolina liquida (rappresentata dal cerchio azzurro), un antibiotico si disperde attraverso una proteina cristallizzata, beta-lattamasi, e si lega ad esso. Le istantanee a raggi X della coppia legata hanno permesso ai ricercatori di creare mappe della densità elettronica (verde) e osservare un anello nell'antibiotico rompersi (estrema destra) da 30 a 500 millisecondi dopo l'inizio della reazione. Credito:Marius Schmidt/ Università del Wisconsin Milwaukee
Gli scienziati della Rice University hanno utilizzato un laser a raggi X a rapida pulsazione per mostrare come i batteri della tubercolosi resistenti ai farmaci disattivano le molecole antibiotiche destinate a trattare la malattia polmonare mortale.
Il biochimico del riso George Phillips e lo studente laureato e co-autore Jose Olmos fanno parte del Centro BioXFEL supportato dalla National Science Foundation che ha catturato i risultati innovativi della prova di principio attraverso una tecnica chiamata cristallografia seriale mix-and-inject.
Per fare ciò è necessario l'uso di un nuovo strumento, un laser a raggi X a elettroni liberi (XFEL) che promette un serio aggiornamento al meticoloso, processo secolare di caratterizzazione delle molecole mediante spettroscopia a raggi X. Il laser si trova presso lo SLAC National Accelerator Laboratory del Dipartimento dell'Energia della Stanford University.
Definire le strutture molecolari è la chiave per capire come funzionano, ha detto Phillips. La nuova scoperta dimostra la capacità in rapido sviluppo degli scienziati di scattare istantanee di processi biologici dinamici mentre si verificano.
Fedele al suo nome, la tecnica mix-and-inject alimenta un flusso ristretto di molecole cristallizzate in una soluzione al laser. Quando il laser colpisce un cristallo con un impulso di 20 femtosecondi (quadrillionesimo di secondo), cancella il cristallo, ma non prima di aver prodotto uno schema di diffrazione su un rivelatore che mostra la struttura atomica della molecola.
In un documento ad accesso libero in BMC Biology, i ricercatori guidati da Marius Schmidt, professore all'Università del Wisconsin-Milwaukee, descritto la miscelazione dell'antibiotico ceftriaxone con un enzima resistente utilizzato dai batteri, beta-lattamasi, e alimentarlo al laser pulsante. Poiché potrebbero regolare il tempo tra la miscelazione e l'arrivo al laser, hanno catturato i modelli di diffrazione delle molecole cristallizzate non solo in orientamenti casuali ma anche in diversi stadi di interazione.
"Mentre ci sono stati studi eleganti per osservare i movimenti delle proteine con i cambiamenti indotti dalla luce, il nostro lavoro illustra che una classe più ampia di proteine, vale a dire enzimi, può essere investigato in modo risolto nel tempo a LCLS (Linac Coherent Light Source) e altri XFEL, " disse Olmo.
Phillips ha affermato che l'esperimento ha dimostrato l'utilità di XFEL nel catturare modelli di diffrazione da cristalli di un milionesimo di metro di diametro o meno, molto più piccolo delle tecniche precedenti. "Questo ci insegnerà di più su come la natura ha selezionato e progettato queste molecole per funzionare, " ha detto. "Non è diverso da vedere una bicicletta che viene pedalata:ottieni più di un'immagine statica e una migliore comprensione di come funziona.
"Ogni volta che vuoi progettare una proteina o ricreare una macchina molecolare, sapere di più su come funzionano a livello fondamentale sarà utile, che si tratti di abbattere la cellulosa per i biocarburanti o progettare un nuovo farmaco o migliorare un farmaco esistente".
Nelle sue presentazioni, Phillips paragona la capacità di scattare istantanee di proteine in azione alle immagini del 19° secolo di Eadweard Muybridge che hanno catturato il movimento a metà corsa di un cavallo al galoppo. (Per caso, il cavallo era di proprietà del fondatore di Stanford.)
I ricercatori si aspettano che XFEL sarà presto aggiornato a Stanford, una nuova struttura in Europa e altre in cantiere in tutto il mondo consentiranno agli scienziati di acquisire strutture in pochi minuti anziché in giorni e fornire loro dati più dettagliati sui processi chimici.
Phillips ha grandi speranze che gli strumenti aggiornati aiuteranno anche a catturare le strutture delle molecole senza doverle prima cristallizzare.
"Se riusciamo a ottenere il raggio di raggi X e la diffusione dello sfondo abbastanza piccoli e il raggio di lettura sufficientemente pulito, poi in teoria invece di far sfilare cristalli, potremmo far sfilare singole molecole nel laser per creare schemi di diffrazione, " Egli ha detto.
"Il laser di Stanford in questo momento spara a 100 hertz (cicli al secondo), " Phillips ha detto. "L'XFEL europeo partirà alle 10, 000 hertz. È un bel miglioramento perché ci dà molte più possibilità di colpire le molecole mentre entrano in circolo".
Ha detto che il centro alla fine spera di acquisire dati strutturali per le reazioni molecolari al volo.
"Potrebbero essere due proteine che si uniscono e imparano a riconoscersi, potrebbe essere l'interazione di un virus con un anticorpo, potrebbe essere l'interazione di un substrato con un enzima o qualsiasi cosa tu possa fare mescolando o con stimolazione esterna, " Phillips ha detto. "Una volta che puoi farlo, il cielo è il limite."