
La microelica autorisonante. (A) Una microelica a cinque giri fabbricata avvolta attorno a un capillare di diametro esterno di 0,4 mm. Durante la fabbricazione, la microelica è strettamente avvolta attorno a una punta da trapano da 0,4 mm e incollata all'interno di un cilindro di Rexolite. La punta del trapano viene rimossa, e la colla viene lasciata asciugare per diversi giorni. Il gruppo della microelica è posto in (B) un gruppo di accoppiamento e supporto, che include un microaccoppiatore planare. (C) Il microaccoppiatore planare è costituito da una corrispondenza di impedenza stripline a un anello di accoppiamento induttivo. SMA, Versione sub-miniatura A. (D) Simulazioni di modellazione ad elementi finiti del campo magnetico a microonde, normalizzato alla potenza in ingresso, a 9,5 GHz mostrano una regione attiva di buona omogeneità del campo magnetico su un'altezza di 0,8 mm. Il campo magnetico a microonde misurato di 3,2 G/W1/2 corrisponde a un impulso /2 di 20 ns a circa 20 mW. Dimensioni della microelica, dove l'autorisonanza è determinata dalla capacità formata tra ciascuna spira e l'induttanza degli avvolgimenti, sono mostrati. La frequenza può essere sintonizzata durante la fabbricazione dal numero di giri, il passo delle virate, o il diametro interno. Credito:progressi scientifici, doi:10.1126/sciadv.aay1394
I biochimici possono utilizzare la risonanza paramagnetica elettronica (EPR) su singoli cristalli proteici per determinare la struttura elettronica definitiva degli intermedi proteici paramagnetici e studiare il tensore magnetico relativo a una struttura molecolare. Il metodo è, però, trattenuta dalle dimensioni tipiche dei cristalli proteici (da 0,05 a 0,3 mm) che non forniscono un'intensità di segnale sufficiente durante la cristallografia proteica. In un nuovo studio su Progressi scientifici , Jason W. Sidabras e un gruppo di ricerca interdisciplinare nei dipartimenti di Conversione di energia chimica, Fotobiotecnologia, L'Istituto di biologia e fisica sperimentale in Germania ha presentato una microelica auto-risonante a microonde per quantificare campioni di nanolitri. Gli scienziati hanno implementato la tecnica in uno spettrometro EPR commerciale in banda X (frequenza media; 9,5 GHz). La microelica auto-risonante ha fornito un miglioramento misurato del rapporto segnale/rumore rispetto ad altri risonatori EPR commerciali. Il lavoro consente alle tecniche EPR avanzate di studiare i cristalli singoli proteici per la cristallografia a raggi X, senza esclusioni o sfide legate alle dimensioni. Per dimostrare il metodo, Sidabras et al. utilizzato proteina monocristallina [FeFe]-idrogenasi (da Clostridium pasteurianum ) con dimensioni di 0,3 mm per 0,1 mm per 0,1 mm.
L'autore principale Jason W. Sidabras, attualmente Marie Sklowdowska-Curie Actions Fellow presso il Max Planck Institute for Chemical Energy Conversion in Germania, ha inoltre commentato il lavoro condotto con i colleghi ricercatori, il professor Wolfgang Lubitz e il dott. Edward J. Reijrse. "Anche se qui abbiamo iniziato con [FeFe]-idrogenasi, abbiamo cercato di studiare la dinamica dell'EPR a cristallo singolo per anni e l'attuale tecnologia non è limitata ai soli metalli di transizione. Il metodo definito nello studio è applicabile per monitorare qualsiasi attività enzimatica all'interno di un intermedio proteico stabile." Ha inoltre osservato del loro obiettivo di utilizzare la tecnologia per ridurre i costi esistenti della tecnologia EPR a impulsi e sostituire i costosi amplificatori ad alta potenza per la scienza frugale (economicamente strategie economiche nella scienza).
Gli scienziati in genere utilizzano la spettroscopia EPR per studiare il ciclo catalitico degli enzimi redox che contengono intermedi paramagnetici e ottenere informazioni sulla struttura elettronica e geometrica di un sito enzimatico attivo. In genere, per condurre esperimenti EPR su proteine, i ricercatori preparano una soluzione congelata (concentrazione tra 0,1 e 1 mM) e mettono un volume (200 µl) in una cavità a microonde per ottenere interazioni magnetiche in un sito attivo, con visione limitata della struttura elettronica. Per risolvere completamente i parametri di interazione magnetica del tensore, devono eseguire esperimenti EPR a cristallo singolo in cui i tensori di interazione magnetica possono essere combinati con la cristallografia a raggi X per dimostrare la geometria delle proteine e comprendere i meccanismi catalitici degli enzimi. Però, L'EPR a cristallo singolo viene raramente applicata ai sistemi proteici a causa delle difficoltà nell'ottenere cristalli con volumi e dimensioni appropriati. Molte proteine nell'intervallo da 0,05 a 0,3 mm sono troppo piccole per l'analisi utilizzando la strumentazione EPR commerciale.
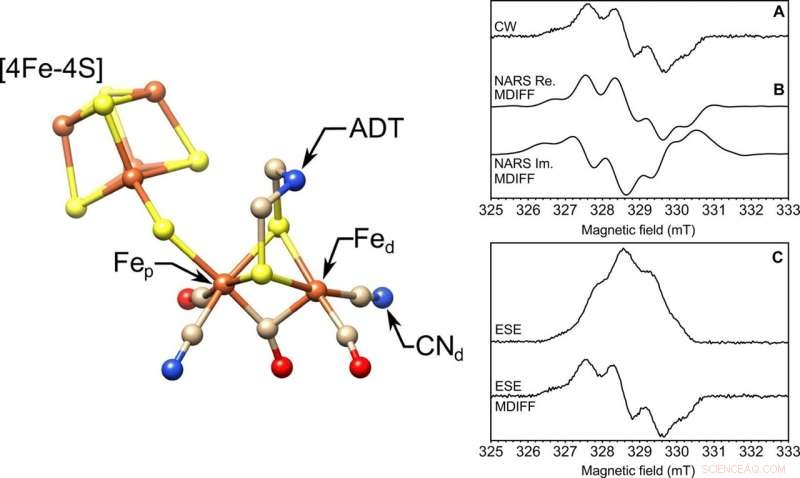
A SINISTRA:La struttura molecolare del sito attivo [FeFe]-idrogenasi, il cluster H. Sono evidenziati i ferri prossimale e distale, Fep e Fed, rispettivamente, il cianuro ligando (CN-d), e il ligando ADT. S, giallo; Fe, arancia; N, blu; C, abbronzatura; Oh, rosso. La struttura proviene da Protein Data Bank (PDB) ID 4XDC. A DESTRA:soluzione congelata EPR su un campione di 85 nl di volume in banda X. Tre esperimenti EPR eseguiti con una microelica autorisonante del diametro interno di 0,4 mm. Sono mostrate le onde continue (A) (CW), (B) scansione rapida non adiabatica (NARS) reale (Re.) e immaginaria (Im.), e (C) esperimenti ESE EPR a due impulsi a scansione di campo del radicale tirosina D (Y∙D) nel fotosistema II con 85 nl di campione di soluzione congelata a una temperatura di 80 K. Pseudo-modulazione MDIFF (differenza mobile) calcolata di Viene mostrato 0,5 mT per gli esperimenti NARS e ESE a scansione di campo da confrontare direttamente con l'esperimento EPR a onda continua. Il tempo totale per gli esperimenti è stato di 49, 55, e 45 minuti, rispettivamente. Il rapporto segnale-rumore viene calcolato e tabulato. Credito:progressi scientifici, doi:10.1126/sciadv.aay1394.
Per migliorare la sensibilità EPR per studiare i cristalli singoli, tipicamente alla banda X, i ricercatori devono abbandonare il design della cavità a microonde e passare a risonatori di piccolo volume nella gamma delle microonde. La strategia può facilitare volumi di campione ridotti da 200 a 20 µl utilizzando un risonatore loop-gap (LGR) e ulteriori riduzioni con materiali ad alta costante dielettrica per ridurre il volume attivo a un microlitro. Le indagini sui singoli cristalli di proteine richiedono ulteriori riduzioni di volume (meno di 0,03 µl) e ciò richiede un approccio radicale. Per realizzare questo, Sidabras et al. combinato una microelica auto-risonante e un microaccoppiatore planare su una configurazione di circuito stampato, che guidava la microelica autorisonante posta al centro dell'anello di accoppiamento. La geometria della microelica offriva vantaggi con un'omogeneità del campo a microonde fortemente migliorata e una maggiore sensibilità al volume per piccoli campioni rispetto ad altri microrisonatori. Il team ha ottimizzato la microelica autorisonante per esperimenti a impulsi e onde continue che richiedono una potenza delle microonde molto ridotta. Hanno facilmente abbinato e sintonizzato la microelica su una varietà di campioni e temperature.
Nel presente lavoro, il team ha utilizzato la microelica auto-risonante per studiare la rotazione dei cristalli EPR di [FeFe]-idrogenasi nello stato ossidato attivo (H BUE ; dimensioni del cristallo 3 mm per 0,1 mm per 0,1 mm), a partire dal Clostridium pasteurianum (batteri anaerobi). Hanno eseguito esperimenti avanzati di EPR a impulsi sulla struttura per osservare un eccellente rapporto segnale-rumore. I dati hanno dimostrato l'uso della microelica per studiare le proteine a cristallo singolo a volumi appropriati per la cristallografia a raggi X. Durante gli esperimenti, il team di ricerca ha avvolto la geometria della microelica autorisonante attorno a un capillare da 0,4 mm e ha collegato l'assieme a un inserto personalizzato compatibile con i sistemi EPR commerciali. Hanno condotto un esperimento EPR a onda continua utilizzando una soluzione congelata e migliorato il rapporto segnale-rumore (SNR) del lavoro utilizzando un esperimento di scansione rapida non adiabatica (NARS) a scansione di campo.
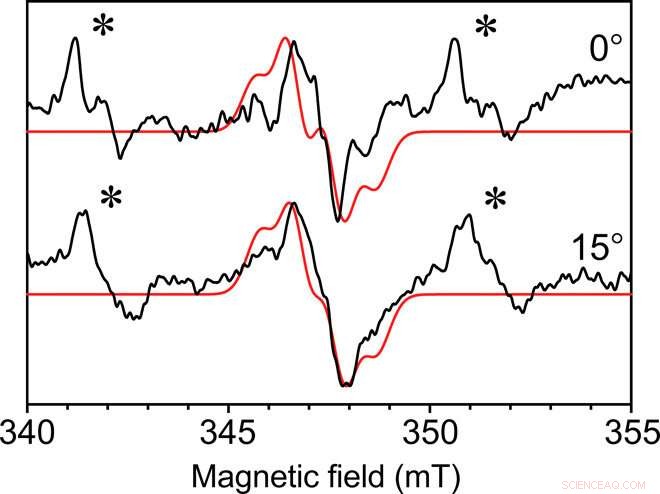
EPR a onda continua a cristallo singolo di Y∙D nel complesso centrale del fotosistema II. EPR a onda continua raccolto con la microelica autorisonante del diametro interno di 0,4 mm a due angoli del radicale fotosistema II Y∙D da un singolo cristallo a una temperatura di 80 K. Le dimensioni del cristallo erano 0,3 mm per 0,18 mm per 0,18 mm. In rosso è mostrata una simulazione adattata con caratteristiche simili. Un segnale Mn2+ non legato in modo specifico è presente anche nelle acque madri del cristallo, indicato da un asterisco (∗). Ogni spettro è stato raccolto in 49 min con un rapporto segnale-rumore di circa 35. Credito:Science Advances, doi:10.1126/sciadv.aay1394.
Hanno usato un radicale tirosina D di lunga durata (Y∙D) come sonda standard durante esperimenti con proprietà precedentemente ben caratterizzate. Per generare il segnale EPR del radicale tirosina (Y∙D), il team ha illuminato campioni del complesso centrale del fotosistema II (complesso proteico di membrana) alla luce ambientale e li ha congelati rapidamente. Hanno condotto numerosi esperimenti per dimostrare la versatilità della microelica durante le misurazioni EPR su una varietà di campioni (meno di 85 nanolitri di volume) in banda X. Sidabras et al. ha utilizzato i cristalli del fotosistema II come punto di riferimento nonostante la sua difficile costituzione. Strutturalmente, il complesso del fotosistema II conteneva una massa molecolare di circa 350 kDa con ciascun componente contenente un solo radicale Y∙D. In totale, con otto complessi del fotosistema II per cella unitaria gli scienziati hanno calcolato 8,9 x 10 12 radicali Y∙D, dimostrare la versatilità del metodo EPR per lo studio di grandi complessi in piccole dimensioni cristalline.
Dopo aver stabilito l'idoneità della microelica autorisonante per lo studio di campioni di proteine monocristalline, il team ha esteso il lavoro per dimostrare la determinazione completa del tensore g angolare (spostamento di energia associato alla transizione molecolare) e per esaminare esperimenti avanzati di EPR a impulsi come la modulazione dell'inviluppo dell'eco dell'eco degli spin degli elettroni (ESEEM) o la correlazione di sottolivello iperfine (HYSCORE). Hanno ottimizzato la microelica autorisonante per questi esperimenti. Il team ha effettuato esperimenti di EPR ESE (electron spin echo) a due impulsi su un singolo cristallo proteico della [FeFe]-idrogenasi di C. pasteurianum (Cpl) nell'H . ossidato BUE stato in una camera anerobica al microscopio per assorbire i cristalli proteici attraverso l'azione capillare in un tubo capillare.

Impulso EPR su un singolo cristallo del cluster H in [FeFe]-idrogenasi. (A) La struttura molecolare del sito attivo [FeFe]-idrogenasi, il cluster H, da PDB ID 4XDC è mostrato con il frame molecolare situato con il ferro distale (Fed) come origine. S, giallo; Fe, arancia; N, blu; C, abbronzatura; Oh, rosso. (B) Lo schema di simmetria P1211 relativo al telaio molecolare (x, si, z) alla cornice di cristallo (a, B, c) e, Ultimo, al telaio del sistema di laboratorio (L1, L2, L3) è mostrato. I due frame molecolari dell'unità asimmetrica sono presenti nel sito I e possono essere tradotti nel sito II mediante operazioni di simmetria del cristallo. (C) Il campo magnetico statico (B0) è posizionato lungo l'asse L1, mentre il campo magnetico a microonde (B1) può essere sia lungo l'asse L2 che lungo l'asse L3. È possibile una rotazione di 180° attorno all'asse L3, ma è fattibile solo una rotazione parziale attorno all'asse L2 perché B1 ruota con il cristallo e B1 diventa parallelo a B0. Una terza rotazione parziale è possibile se il campione viene ruotato di 90° attorno all'asse L2. (D) Esperimenti EPR a impulsi raccolti con la microelica autorisonante del diametro interno di 0,4 mm con un cristallo singolo [FeFe]-idrogenasi di C. pasteurianum (CpI) nello stato Hox che mostrano i dati raccolti in un piano per una rotazione completa di 180 ° in passi di 5° ad una temperatura di 15 K. Le dimensioni del cristallo erano di circa 0,3 mm per 0,1 mm per 0,1 mm, e ogni spettro è stato raccolto in 8 minuti con un rapporto segnale-rumore di circa 290. (E) Una visione stereo del tensore g analizzato (gx, rosso; gia, verde; e gz, blu) è mappato sulla struttura cristallina (ID PDB:4XDC). Per una vista tridimensionale (3D) del tensore g proposto, vedere https://act-epr.org/FeFeHydrogenase.html. Credito:progressi scientifici, doi:10.1126/sciadv.aay1394.
Hanno quindi incluso crioprotettore e supporti nella microelica, seguiti da un congelamento rapido per produrre un segnale EPR con quattro segnali distinti nello spettro relativo alla struttura della proteina. Gli scienziati hanno inserito i dati in simulazioni relative a diversi quadri di riferimento definiti tramite il pacchetto di simulazione EasySpin per la simulazione dello spettro EPR. Il team ha creato uno schema che mette in relazione la struttura molecolare del cluster H di [FeFe]-idrogenasi con la struttura del sistema di laboratorio. Per tutte le specie esaminate negli esperimenti, il team ha determinato l'ampiezza e l'orientamento del tensore g utilizzando la teoria del campo di ligandi e ha verificato i risultati utilizzando calcoli di chimica quantistica. Il team ha facilitato approfondimenti fondamentali sulla struttura elettronica e ha notato la loro dipendenza dalla sfera del ligando e ha osservato la necessità di strategie ottimizzate.
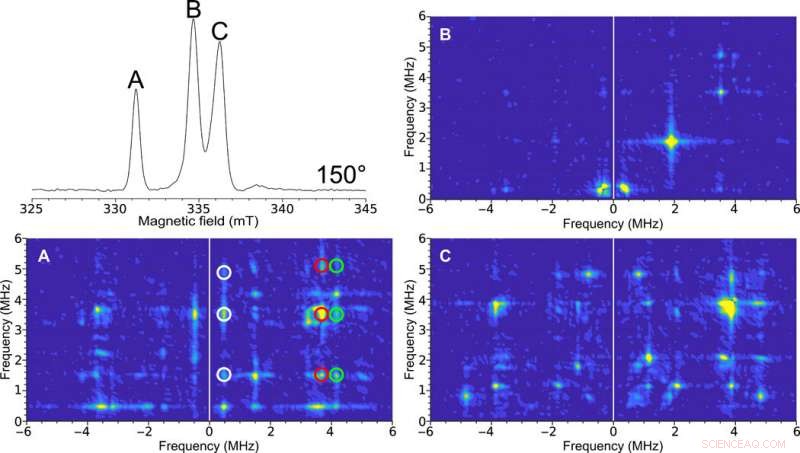
HYSCORE EPR monocristallo del cluster H in [FeFe]-idrogenasi. In alto a sinistra:spettro ESE EPR a due impulsi a scansione di campo a 150°. Le etichette delle figure (A, B, e C) sono rappresentativi dei picchi spettrali. Gli spettri HYSCORE raccolti con la microelica autorisonante del diametro interno di 0,4 mm di un cristallo singolo di [FeFe]-idrogenasi di C. pasteurianum (CpI) allo stato Hox ad un orientamento di 150° raccolti a una temperatura di 15 K. Il 2D la rappresentazione della densità mostra le correlazioni tra le transizioni di spin nucleare in entrambe le proiezioni dello spin elettronico. (A) Spettro HYSCORE pulito a causa del picco corrispondente a uno solo dei segnali EPR nella cella unitaria del cristallo. Le caratteristiche correlate tra queste transizioni sono indicate dal bianco, rosso, e cerchi verdi. (B) Lo spettro HYSCORE relativamente privo di caratteristiche suggerisce una scarsa interazione iperfine a questo orientamento. (C) HYSCORE su due segnali EPR sovrapposti che rappresentano diversi orientamenti della molecola dell'enzima rispetto al campo magnetico. HYSCORE è stato impostato utilizzando la procedura guidata Bruker HYSCORE con le seguenti impostazioni:π/2, 40 ns; , 280 ns; e , 48 ns con 256 punti ciascuno e 20 colpi per punto. Ciascuno spettro HYSCORE è stato raccolto in circa 1 ora. Credito:progressi scientifici, doi:10.1126/sciadv.aay1394.
The researchers illustrated more advanced experiments for single-crystal studies using HYSCORE (hyperfine sublevel correlation) experiments for the ESE (electron spin echo) EPR dataset. Per questo, they obtained a single-crystal 2-D spectrum for the H-cluster in [FeFe]-hydrogenase crystals and identified six main transitions. Sidabras et al. highlighted the feasibility of these advanced EPR techniques in the present work and related them to the electronic structure predicted using quantum chemical calculations. The team aim to address additional molecular couplings of ligands in depth using ESEEM/HYSCORE techniques in the future.
In questo modo, Jason W. Sidabras and colleagues presented an advanced resonator to design and collect EPR data from a 3 mm by 0.1 mm by 0.1 mm single crystal of [FeFe]-hydrogenase in the H BUE state from C. pasteurianum (Cpl). The HYSCORE spectra obtained from a protein single crystal in the present work were a first in study. Additional work proposed by the team will facilitate further insight for protein engineering and artificial enzyme research to create bioinspired and biomimetic enzymatic systems. In particolare, the self-resonant microhelix engineered in the work can allow biochemists to study diverse catalytically active proteins at crystal dimensions relative to X-ray crystallography, which will pave the way for significant advancements in the field of enzyme research.
© 2019 Scienza X Rete