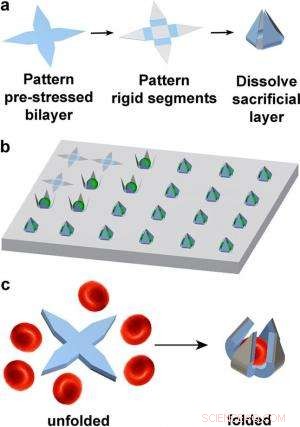
Illustrazione della fabbricazione di pinze unicellulari e della cattura dei globuli rossi. Credito:Malachowski, et al. ©2014 American Chemical Society
(Phys.org) —Non esistono due cellule biologiche esattamente uguali. Anche un piccolo campione di tumore sottoposto a biopsia contiene cellule con grandi variazioni nel loro tasso di proliferazione, possibilità di metastasi, reattività ai farmaci, ecc. Tuttavia, a causa delle grandi dimensioni degli strumenti utilizzati per analizzare le cellule, i dati raccolti da campioni di tessuto sono spesso mediati su una moltitudine di cellule. Come tale, potrebbe non rappresentare accuratamente il comportamento delle singole cellule di interesse. Poiché l'analisi delle singole cellule è molto importante per la progettazione di trattamenti efficaci, i ricercatori stanno lavorando su modi per catturare singole cellule, e molti di loro in una volta.
In un nuovo studio pubblicato su Nano lettere , ricercatori della Johns Hopkins University di Baltimora, Maryland, e il laboratorio di ricerca dell'esercito americano ad Adelphi, Maryland, hanno progettato e fabbricato minuscole pinze auto-pieghevoli in grado di catturare singole cellule sotto in vitro e potenzialmente in vivo ambienti. Le pinze possono essere prodotte in serie, con forse 100 milioni su un wafer da 12 pollici, e potenzialmente diretto a una parte specifica del corpo per catturare tipi specifici di cellule. Un po' come il modo in cui un acchiappamosche venere cattura la sua preda, le pinze auto-pieghevoli avvolgono le braccia attorno alle cellule bersaglio, pur senza ucciderli. Negli esperimenti, i ricercatori hanno dimostrato che le pinze possono catturare cellule di fibroblasti di topo in vitro , così come i globuli rossi.
"Riteniamo che questo sia un passo importante verso l'obiettivo di acquisire e analizzare singole celle all'interno dello stesso dispositivo in modo ad alto rendimento in entrambe le condizioni. in vitro e in vivo condizioni, " David H. Gracias, Professore alla Johns Hopkins University, detto Phys.org .
Questa pinza non è il primo dispositivo in grado di catturare singole celle. Attualmente, una vasta gamma di tecniche come trappole ottiche e microfluidiche, citometria a flusso (in cui un laser viene utilizzato per sospendere le cellule in un flusso di fluido), sono disponibili micropozzetti e persino dispositivi robotici in miniatura per in vitro analisi unicellulare. Però, queste tecniche affrontano problemi come perdere la presa sulle celle o richiedere fili e cavi che limitano la mobilità, limitandone l'uso.
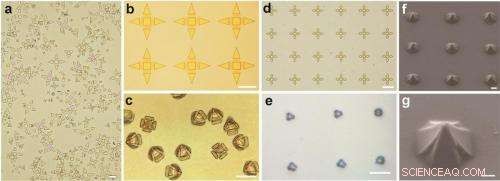
(a--e) ottico e (f, g) Immagini SEM di pinze unicellulari. Credito:Malachowski, et al. ©2014 American Chemical Society
La pinza autopiegante sviluppata nel nuovo studio supera questi problemi perché ha la capacità di afferrare le cellule utilizzando solo l'energia proveniente dal rilascio di stress nei propri materiali, senza bisogno di cavi, legami, o batterie. Il meccanismo di presa avviene perché le "cerniere" della pinza sono realizzate in SiO/SiO precompresso 2 doppio strato. Le cerniere sono collegate ad un corpo rigido e bracci realizzati solo in SiO. Quando esposto a una soluzione salina, lo strato sacrificale sottostante rilascia le braccia e le fa arricciare verso l'alto e chiudersi intorno a una cellula. In quanto materiali biocompatibili e bioriassorbibili, film sottili sia di SiO che di SiO 2 dissolversi nei fluidi biologici nel tempo.
I ricercatori hanno dimostrato che, utilizzando la fotolitografia, le pinze possono essere fabbricate in dimensioni che vanno da 10 a 70 µm da punta a punta quando aperte, che è un intervallo di dimensioni appropriato per afferrare una varietà di singole celle. Le pinze possono essere piegate ad angoli che vanno da 90° a 115° controllando lo spessore del film a doppio strato. Poiché le pinze hanno aperture a fessura all'intersezione dei bracci, nutrienti, sciupare, e altre sostanze biochimiche possono facilmente fluire da e verso le cellule. Gli esperimenti hanno confermato che le pinze non hanno ucciso le cellule, sebbene alcune celle si adattassero alla forma delle pinze. Poiché le pinze sono otticamente trasparenti, sono ideali per l'imaging delle cellule intrappolate utilizzando microscopi ottici. Sebbene non sia attualmente possibile controllare i tempi di chiusura delle pinze, i ricercatori spiegano che in futuro potrebbe essere possibile consentire loro di rispondere e avvicinarsi a sostanze chimiche specifiche.
"In questo momento le pinze si chiudono spontaneamente al rilascio dal substrato, quindi la cattura è statistica, " Ha detto Gracias. " Altrove abbiamo dimostrato con pinze più grandi che è possibile aggiungere un trigger polimerico per rendere tali strumenti sensibili alla temperatura e persino agli enzimi come le proteasi. Quindi le pinze a cella singola potrebbero anche essere potenzialmente rese reattive alle singole celle quando rivestite con gli elementi di riconoscimento appropriati".
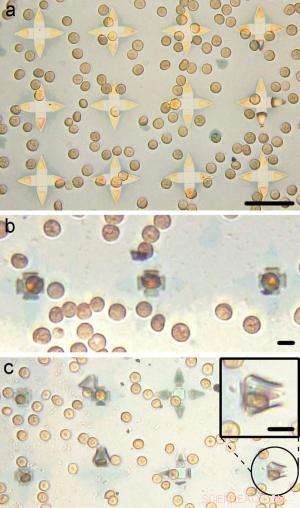
Immagini ottiche di globuli rossi intrappolati in pinze da 35 micrometri. Credito:Malachowski, et al. ©2014 American Chemical Society
Poiché le pinze sono così piccole, hanno il potenziale per essere utilizzati in molte parti del corpo. Per esempio, potrebbero passare attraverso stretti condotti all'interno del circolatorio, nervoso centrale, e sistemi urogenitali. Per questi in vivo usi, le pinze potrebbero essere guidate da elementi ferromagnetici, e biomarcatori modellati su di essi potrebbero essere utilizzati per mirare a specifiche cellule malate. Per in vitro usi, la guida potrebbe essere ottenuta anche drogando le pinze con elementi magnetici come nichel, e utilizzando campi magnetici per spostare le pinze. Globale, i minuscoli strumenti hanno il potenziale per creare grandi miglioramenti in molte aree della medicina, su cui i ricercatori intendono continuare a lavorare.
"Sul in vitro stiamo cercando di sviluppare un saggio ad alto rendimento per la cattura e l'analisi di singole cellule utilizzando modalità ottiche ed elettriche su un chip, " Ha detto Gracias. "Sul in vivo lato, vorremmo esplorare la possibilità di biopsia e cattura specifica delle cellule in luoghi difficili da raggiungere in vivo ."
© 2014 Phys.org