
Fig. 1. Illustrazione schematica di un sacco racchiuso in una membrana a tre zone, formato come una goccia di HA in soluzione cade in una soluzione di PA. Lo strato più interno (1) è un gel di molecole di HA. È circondato da uno strato di nanofibre che giace tangenzialmente alla superficie del sacco (2), da cui emergono perpendicolarmente le nanofibre (3).
Le tecniche per creare materiali nanostrutturati complessi attraverso l'autoassemblaggio di molecole sono diventate sempre più sofisticate. Ma portare queste tecniche nel regno biologico è stato problematico. Recentemente, gli scienziati della Northwestern University hanno utilizzato l'autoassemblaggio in condizioni controllate per creare una membrana costituita da strati con strutture nettamente diverse. Ora, lavorando presso l'Advanced Photon Source (APS) del Dipartimento dell'Energia degli Stati Uniti, il team ha utilizzato la diffusione di raggi X a piccolo angolo (SAXS) per determinare meglio queste strutture e studiare come si formano. Queste nuove informazioni aprono la strada alla progettazione e alla sintesi di strutture gerarchiche con applicazioni biomediche.
Gli anfifili peptidici (PA) sono catene di amminoacidi inclinate con altre molecole in modo che un'estremità sia idrofila (si mescola bene con l'acqua) e l'altra idrofobica (non ama l'acqua). In soluzione acquosa, Le PA si formano lunghe, nanofibre sottili poiché le catene di amminoacidi si legano alle catene adiacenti per formare fogli . Gli scienziati della Northwestern University avevano precedentemente scoperto che quando una soluzione acquosa contenente PA caricati positivamente veniva messa in contatto con una soluzione acquosa di acido ialuronico caricato negativamente (HA, una grande molecola biologica che si trova nel connettivo e in altri tessuti), un denso, strato fibroso formato in millisecondi, creando una barriera che impediva alle due soluzioni di mescolarsi.
Più precisamente, i ricercatori hanno scoperto che lo strato fibroso impedisce ai PA aggregati di migrare verso il lato HA, ma consente alle molecole di HA di insinuarsi lentamente attraverso la barriera verso il lato PA, su una scala temporale di minuti o più.
Il risultato è stata una struttura a membrana a tre zone:uno strato simile al gel sul lato HA, un materassino fibroso costituito da nanofibre di PA che giace nel piano dell'interfaccia tra le soluzioni, e un rivestimento di fibre dirette perpendicolarmente lontano dall'interfaccia e formato da complessi legati elettrostaticamente di PA e HA (Fig. 1).
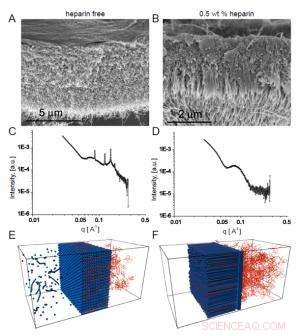
Fig. 2. Le micrografie elettroniche a scansione mostrano la membrana omogenea che si forma in assenza di eparina (A), mentre in presenza di eparina si forma una struttura fibrosa trasversale alla membrana (B).
L'interesse del team per queste membrane dipendeva da possibili usi biomedici in cui la sequenza peptidica che formava le nanofibre avrebbe avuto un'attività biologica prescelta. In un esempio, hanno incorporato una sequenza legante l'eparina per promuovere l'angiogenesi (la formazione di nuovi vasi sanguigni), in modo che la membrana possa aiutare con la riparazione dei tessuti. Per formare la struttura a tre zone, i ricercatori hanno scoperto che la soluzione di HA doveva contenere eparina in un certo intervallo di concentrazione. La microscopia elettronica a scansione ha mostrato chiaramente una struttura lineare che attraversa la membrana che si è formata quando l'eparina era presente allo 0,5% in peso (Fig. 2a), in contrasto con l'aspetto più omogeneo della membrana che si crea in assenza di eparina (Fig. 2b).
Gli scienziati si sono rivolti a SAXS presso il DuPont-Northwestern-Dow Collaborative Access Team beamline 5-ID-D presso l'Argonne APS, una struttura per gli utenti dell'Office of Science. Questi studi forniscono informazioni sulla struttura precisa delle membrane a tre zone e una migliore comprensione delle dinamiche della loro formazione.
Le membrane prive di eparina hanno prodotto picchi di Bragg ben definiti, mentre le membrane a tre zone no. Inoltre, le membrane che si sono formate in presenza di concentrazioni di eparina più piccole hanno mostrato picchi di Bragg più grandi di quelli prodotti quando la concentrazione di eparina era più alta, indicando una competizione tra due strutture il cui esito dipendeva dai livelli di eparina.
Una serie temporale di misurazioni SAXS su un esperimento senza eparina ha mostrato che i picchi di Bragg hanno iniziato a formarsi pochi minuti dopo che le due soluzioni sono state messe in contatto, e ha raggiunto la piena forza dopo circa 45 minuti.
Interpretando i risultati di SAXS alla luce dei loro esperimenti precedenti e delle proprietà note di PA e HA, gli scienziati spiegano le differenze tra i due tipi di membrana come risultato di diversi tipi di aggregazione. In assenza di eparina, il PA e l'HA si uniscono in aggregati nanosferici che si impacchettano insieme in una disposizione cubica, nell'arco di qualche decina di minuti, per formare una membrana che genera picchi di Bragg ben definiti.
Quando l'eparina è presente, al contrario, si lega fortemente con la PA e altera la sua interazione con le molecole di AH. In questo caso, si forma immediatamente una barriera di nanofibre parallele all'interfaccia della soluzione, quindi agisce come una barriera alla diffusione attraverso la quale l'HA passa lentamente. Come emerge dall'altra parte, si lega alla PA per formare nanofibre che crescono perpendicolarmente all'interfaccia. Questo array ordinato di nanofibre non produce picchi di Bragg.
La maggiore comprensione e controllo di questi processi derivati da questa ricerca potrebbe rendere possibile la costruzione di membrane bioattive con una varietà di strutture e scopi.