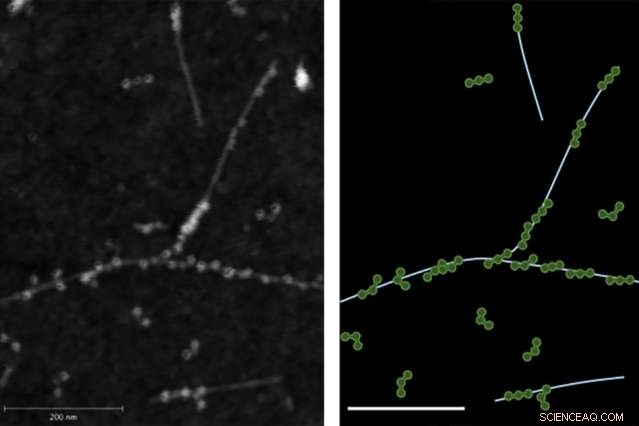
L'immagine di microscopia a forza atomica (AFM) a sinistra dimostra il legame fisico tra le proteine del fibrinogeno e i nanotubi di carbonio a parete singola. La destra mostra una traccia dell'immagine AFM con il fibrinogeno in verde e i nanotubi in azzurro.
Utilizzando nanotubi di carbonio, Gli ingegneri chimici del MIT hanno ideato un nuovo metodo per rilevare le proteine, compreso il fibrinogeno, uno dei fattori di coagulazione critici per la cascata della coagulazione del sangue.
Questo approccio, se sviluppato in un sensore impiantabile, potrebbe essere utile per monitorare i pazienti che assumono anticoagulanti, consentendo ai medici di assicurarsi che i farmaci non interferiscano troppo con la coagulazione del sangue.
Il nuovo metodo è il primo a creare siti di riconoscimento sintetici (simili agli anticorpi naturali) per le proteine e ad accoppiarli direttamente a un potente nanosensore come un nanotubo di carbonio. I ricercatori hanno anche compiuto progressi significativi su un sito di riconoscimento simile per l'insulina, che potrebbe consentire un migliore monitoraggio dei pazienti con diabete. Potrebbe anche essere possibile utilizzare questo approccio per rilevare proteine associate a cancro o malattie cardiache, dice Michele Strano, il Carbon P. Dubbs Professor in Ingegneria Chimica al MIT.
Strano è l'autore senior di un articolo che descrive il metodo in Nature Communications. Gili Bisker, un postdoc nel laboratorio di Strano, è l'autore principale del documento.
Una ricerca mirata
Il nuovo sensore è l'ultimo esempio di un metodo sviluppato nel laboratorio di Strano, noto come riconoscimento molecolare in fase corona (CoPhMoRe).

Questa immagine al microscopio elettronico a scansione mostra nanotubi di carbonio a parete singola, il materiale di partenza utilizzato dai ricercatori.
Questa tecnica sfrutta le interazioni tra un dato polimero e una superficie di nanoparticelle come quella di un nanotubo di carbonio a parete singola fluorescente, quando il polimero è avvolto attorno al nanotubo.
Alcune regioni dei polimeri si agganciano alla superficie delle nanoparticelle come ancore, mentre altre regioni si estendono verso l'esterno nel loro ambiente. Questa regione rivolta verso l'esterno, nota anche come fase adsorbita o corona, ha una struttura 3D che dipende dalla composizione del polimero.
CoPhMoRe funziona quando un polimero specifico si adsorbe sulla superficie della nanoparticella e crea una corona che riconosce la molecola bersaglio. Queste interazioni sono molto specifiche, proprio come il legame tra un anticorpo e il suo bersaglio. Il legame del bersaglio altera la fluorescenza naturale dei nanotubi di carbonio, consentendo ai ricercatori di misurare la quantità di molecola bersaglio presente.
Il laboratorio di Strano ha precedentemente utilizzato questo approccio per trovare siti di riconoscimento e sviluppare nanosensori per estradiolo e riboflavina, tra le altre molecole. Il nuovo documento rappresenta il loro primo tentativo di identificare fasi corona in grado di rilevare proteine, che sono più grandi, più complesso, e più fragili delle molecole identificate dai loro sensori precedenti.
Per questo studio, Bisker ha iniziato con lo screening di nanotubi di carbonio avvolti in 20 diversi polimeri tra cui DNA, RNA, e glicole polietilenico (PEG), un polimero spesso aggiunto ai farmaci per aumentarne la longevità nel flusso sanguigno.
Da soli, nessuno dei polimeri aveva alcuna affinità per le 14 proteine testate, tutto preso dal sangue umano. Però, quando i ricercatori hanno testato i nanotubi avvolti in polimeri contro le stesse proteine, hanno scoperto una corrispondenza tra uno dei nanotubi modificati e il fibrinogeno.
"Un chimico o un biologo non sarebbe in grado di prevedere in anticipo che dovrebbe esserci alcun tipo di affinità tra il fibrinogeno e questa fase corona, "Dice Strano. "Si tratta davvero di un nuovo tipo di riconoscimento molecolare".
fibrinogeno, una delle proteine più abbondanti nel sangue umano, fa parte della cascata della coagulazione del sangue. Quando un vaso sanguigno è danneggiato, un enzima chiamato trombina converte il fibrinogeno in fibrina, una proteina fibrosa che forma coaguli per sigillare la ferita.
Un sensore per il fibrinogeno potrebbe aiutare i medici a determinare se i pazienti che assumono anticoagulanti hanno ancora una capacità di coagulazione sufficiente per proteggerli da lesioni, e potrebbe consentire ai medici di calcolare dosaggi più precisi. Potrebbe anche essere usato per testare la coagulazione del sangue dei pazienti prima che vadano in chirurgia, o per monitorare la guarigione delle ferite, dice Bisker.
Anticorpi sintetici
I ricercatori ritengono che i loro agenti di riconoscimento molecolare sintetici siano un miglioramento rispetto ai sistemi naturali esistenti basati su anticorpi o sequenze di DNA noti come aptameri, che sono più fragili e tendono a degradarsi nel tempo.
"Uno dei vantaggi di questo è che è un sistema completamente sintetico che può avere una durata molto più lunga all'interno del corpo, "dice Bisker.
Nel 2013, i ricercatori del laboratorio di Strano hanno dimostrato che i sensori di nanotubi di carbonio possono rimanere attivi nei topi per più di un anno dopo essere stati incorporati in un gel polimerico e impiantati chirurgicamente sotto la pelle.
Oltre all'insulina, i ricercatori sono anche interessati a rilevare la troponina, una proteina che viene rilasciata dalle cellule cardiache morenti, o rilevare proteine associate al cancro, che sarebbe utile per monitorare il successo della chemioterapia. Questi e altri sensori proteici potrebbero diventare componenti critici di dispositivi che forniscono farmaci in risposta a un segno di malattia.
"Misurando i marcatori terapeutici nel corpo umano in tempo reale, possiamo abilitare sistemi di somministrazione dei farmaci molto più intelligenti, e rilasciare farmaci in quantità precise, " dice Strano. "Tuttavia, la misurazione di questi biomarcatori è il primo passo".