
a) Microstruttura di scaffold di collagene caricato cellulare esaminati in TEM. Le cellule sono circondate dalla matrice di collagene. Le fibrille di collagene non hanno mostrato alcuna direzione preferita attorno alle cellule in condizioni di controllo, b) Gli IONP possono essere identificati nella matrice di collagene ec) vicino alle membrane cellulari. Dopo 14 giorni una nuova matrice è stata sintetizzata dalle cellule, d) senza SMF ed e) con SMF. Entrambe le condizioni hanno portato alla nuova sintesi della matrice dopo 14 giorni, senza una differenza significativa. Credito: Rapporti scientifici , doi:10.1038/s41598-018-33455-2.
I meccanismi cellulari e molecolari della rigenerazione ossea basata sulla stimolazione magnetica richiedono attualmente un'ulteriore comprensione. Per valutare il fenomeno in laboratorio, un modello di collagene nativo tridimensionale (3-D) è stato recentemente sviluppato tramite compressione plastica per produrre un struttura del collagene densa e meccanicamente forte. Per produrre modelli carichi di cellule nello studio, Zhiyu Yuan e colleghi hanno incorporato cellule di osteoblasti (linea cellulare MG-63) e nanoparticelle di ossido di ferro magnetico (IONP) nei gel di collagene. Utilizzando la stampa 3D, un bioreattore magnetico è stato progettato e fabbricato per supportare la crescita cellulare sotto campi magnetici statici (SMF). Utilizzando la reazione a catena della polimerasi (PCR), i ricercatori hanno determinato l'impatto degli SMF sulla regolazione e sull'espressione dei geni correlati all'osteogenesi, incluso il fattore di trascrizione 2 (Runx2) correlato al runt, osteonectina (ON) e proteine morfogenetiche ossee 2 e 4 (BMP-2 e BMP-4).
Ora pubblicato in Rapporti scientifici , i risultati hanno dimostrato che gli SMF, Gli IONP e la matrice di collagene sono stati in grado di stimolare la proliferazione, produzione di fosfatasi alcalina e mineralizzazione degli osteoblasti. Il processo è stato abilitato influenzando le interazioni matrice-cellula per influenzare l'espressione di Runx2, SU, BMP-2 e BMP-4. Il modello di collagene ha offerto informazioni per formare progressivamente un nuovo modello osseo 3D mineralizzato e comprendere la stimolazione magnetica sull'osteogenesi. Ulteriori studi possono essere condotti con il modello per applicazioni nell'ingegneria dei tessuti e nella medicina rigenerativa.
Nel solo Regno Unito, il numero di pazienti affetti da frattura ossea ha un impatto economico sostanziale sulla qualità della vita come evidenziato dai costi per il Servizio Sanitario Nazionale (SSN). Durante la lesione ossea, il processo biologico e meccanico di rigenerazione fisiologica sostituisce l'osso danneggiato con nuovo osso nel sito della lesione. Il processo metabolico è complicato e richiede l'interazione di molti fattori, compresi fattori di crescita e differenziazione come ormoni, citochine e componenti extracellulari; nel frattempo, fattori inadeguati o interrotti possono portare a una guarigione ritardata o a una compromissione/non unione dell'osso.
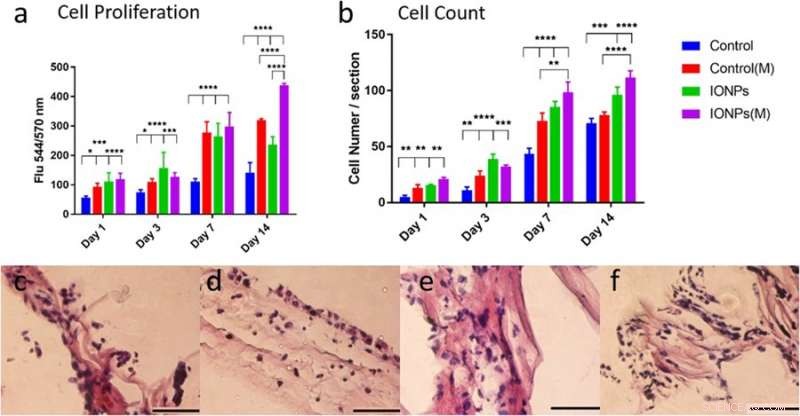
a) confronto della proliferazione cellulare MG-63 in coltura con/senza l'incorporazione di IONP con esposizione di SMF (M) e senza esposizione di SMF. La proliferazione cellulare può essere potenziata con SMF incorporando IONP, indicando un effetto stimolante, b) Confrontando i numeri di cellule delle linee cellulari MG-63 da immagini istologiche con o senza SMF. Le risposte cellulari della linea cellulare MG-63 coltivata su impalcatura di collagene PC sono state esaminate anche mediante istologia per le condizioni c) senza SMF e senza IONP, d) con SMF, e) con IONP ed e) combinazione di SMF e IONP. Credito: Rapporti scientifici , doi:10.1038/s41598-018-33455-2.
Nello studio, gli autori hanno usato un romanzo, modello di collagene 3-D biomimetico multifunzionale da utilizzare come piattaforma in vitro per lo studio dei meccanismi di stimolazione magnetica sull'osteogenesi. Per produrre una gamma di modelli carichi di cellule, i ricercatori hanno introdotto stimoli interni (nanoparticelle di ossido di ferro) ed esterni (campi magnetici statici, SMF) stimoli nel sistema. Il materiale biomimetico è stato ingegnerizzato mediante la fabbricazione di nano e microstrutture mediante compressione plastica, secondo un protocollo precedentemente stabilito. Per valutare i comportamenti biologici degli osteoblasti, compresa la loro proliferazione, differenziazione, mineralizzazione, analisi dell'espressione genica e della microstruttura, gli scienziati hanno coltivato il modello di collagene in un bioreattore magnetico per un massimo di 42 giorni.
Nello studio, la proliferazione cellulare della linea cellulare di osteoblasti MG-63 è stata valutata utilizzando il test alamarBlue. Al giorno 14, i ricercatori hanno osservato una differenza significativa tra i soli SMF, IONP da soli e in loro combinazione sulla proliferazione cellulare. Sono state impiegate tecniche istologiche per esaminare le risposte cellulari all'interno degli scaffold di collagene e comprendere il ruolo degli SMF e degli IONP sulla proliferazione cellulare. La visualizzazione è stata seguita da un'analisi quantitativa dei numeri di cellule, i risultati hanno indicato che l'incorporazione di IONP ha prolungato l'effetto degli SMF.
Allo stesso modo, la differenziazione cellulare è stata osservata con attività di fosfatasi alcalina (ALP) per scaffold di collagene, con o senza l'incorporazione di IONP. Come prima, quando l'effetto di IONP e SMF sono stati combinati, la produzione di ALP è stata significativamente stimolata rispetto al trattamento con soli SMF e soli IONP. Successivamente è stata osservata e quantificata anche la mineralizzazione cellulare nello scaffold di collagene seminato dalle cellule. Dopo 42 giorni tutti i campioni sono stati colorati con colorazione ARS per indicare la completa mineralizzazione. In contrasto, la combinazione di SMF e IONP non è stata in grado di promuovere la mineralizzazione.
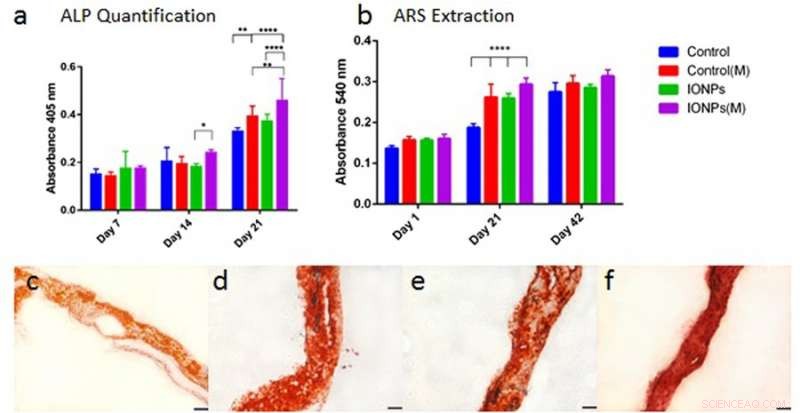
a) confrontare la produzione di ALP della linea cellulare MG-63 quando coltivata all'interno di scaffold di collagene con o senza l'incorporazione di IONP, con esposizione a SMF (M) e senza esposizione a SMF. b) Confrontando la mineralizzazione cellulare estraendo e quantificando la colorazione ARS da scaffold trattati con o senza esposizione a SMF. Gli scaffold di collagene caricati con cellule sono stati integrati con IONP (100 µg/ml) i risultati sono stati raccolti su 1, 21 e 42 giorni di cultura. c) colorazione ARS dello scaffold di collagene in assenza di SMF e IONP, d) con SMF, e) con IONP, e f) con SMF e IONP. Credito: Rapporti scientifici , doi:10.1038/s41598-018-33455-2.
Successivamente, gli scienziati hanno condotto studi per comprendere le risposte degli scaffold di collagene seminato nelle cellule agli SMF e agli IONP a livello molecolare. Per questo, i livelli di espressione di Runx2, SU, BMP-2 e BMP-4 sono stati quantificati utilizzando la reazione a catena della polimerasi quantitativa in tempo reale (RT-qPCR). Un trattamento di 7 giorni dei soli SMF non ha avuto effetto sull'espressione di Runx2, considerando che è stata riscontrata una maggiore espressione quando gli SMF sono stati combinati con IONP, dimostrando l'espressione Runx2 mediata dalla matrice di collagene durante l'osteogenesi. Al giorno 7 il livello di espressione ON nei campioni trattati con IONP, Gli SMF ed entrambi erano più alti rispetto al controllo in un breve periodo di tempo. Durante l'espressione di BMP-2 e BMP-4, risultati simili sono stati osservati per 7-14 giorni.
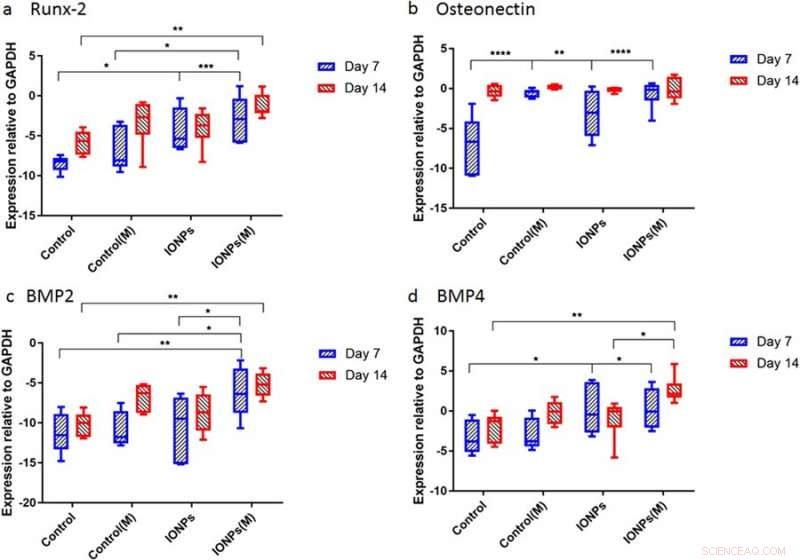
Espressione genica per a) Runx2, b) osteonectina (ON), c) BMP-2 e d) BMP-4 normalizzato con il controllo GAPDH dopo 7 e 14 giorni di coltura cellulare. Credito: Rapporti scientifici , doi:10.1038/s41598-018-33455-2.
Lo studio ha dimostrato principalmente l'osteogenesi come un processo complesso mediato dalla successiva attivazione ed espressione di diversi geni chiave, compreso Runx2, SU, BMP-2 e BMP-4. Tipicamente, Runx2 sovraregola l'espressione dei geni proteici correlati alla matrice ossea per promuovere la formazione ossea in vitro e in vivo. Di conseguenza, lo studio ha mostrato che l'esposizione a SMF può indurre la linea cellulare a proliferare modulando l'espressione precoce di Runx2, per accelerare l'osteogenesi. Quando gli IONP sono stati incorporati nelle SMF, l'espressione del gene dell'ostenectina (ON) è aumentata, collegare le fasi del collagene con il minerale osseo per avviare la normale mineralizzazione del tessuto scheletrico. Allo stesso modo, sia BMP-2 che BMP-4 sono stati aumentati solo nello studio durante la coltura cellulare combinata con SMF e IONP.
In questo modo, gli autori hanno sviluppato e testato un modello di collagene 3-D biomimetico che potrebbe mineralizzarsi progressivamente per formare successivamente un nuovo modello osseo in vitro. Il modello è stato incorporato con cellule di osteoblasti e nanoparticelle con la capacità di rispondere a stimolazioni magnetiche esterne. Il modello di collagene biomimetico è stato progettato tramite compressione plastica per integrare la linea cellulare MG-63 e dimostrare risultati riproducibili e coerenti combinati con SMF e IONP. Le interazioni cellula-matrice hanno sovraregolato con successo l'espressione di geni chiave correlati all'osteogenesi. Gli autori intendono sviluppare ulteriormente il modello 3D per fungere da piattaforma superiore per studiare i comportamenti biologici in vitro con potenziali applicazioni nell'ingegneria dei tessuti e nella medicina rigenerativa.
© 2018 Science X Network