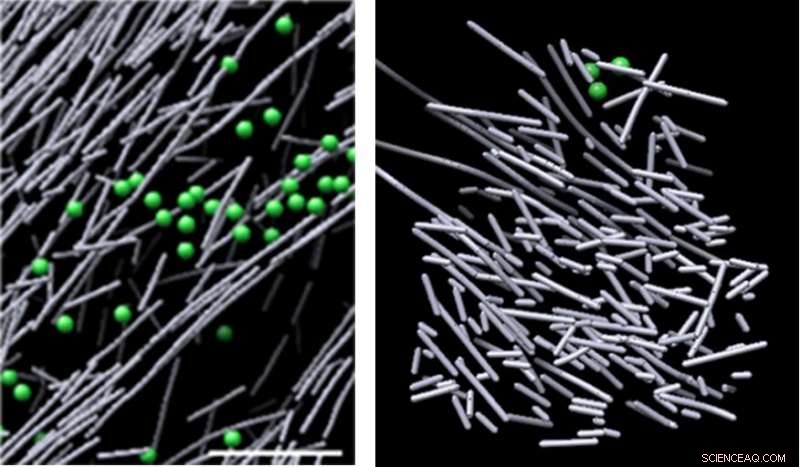
Immagini al microscopio crioelettronico dell'assemblaggio dell'actina nella cellula in assenza di un segnale molecolare (a sinistra) e del nanoscaffold del filamento di actina simile a un pagliaio che è stato indotto in risposta a un segnale molecolare (Rac1) e promuove il movimento cellulare (a destra). La struttura è apparsa in vista in regioni definite in cui è stato attivato Rac1, e si è rapidamente dissipato quando la segnalazione di Rac1 si è interrotta, in appena due minuti e mezzo. Credito:Sanford Burnham Prebys Medical Discovery Institute (SBP)
Ci sono molte volte in cui le nostre cellule hanno bisogno di muoversi. Le cellule mobili guidano la formazione del nostro corpo (sviluppo embrionale). Le cellule immunitarie vagano per catturare gli intrusi indesiderati. E le cellule curative (fibroblasti) migrano per riparare le ferite. Ma non tutti i movimenti sono desiderabili:i tumori sono più pericolosi quando le cellule tumorali acquisiscono la capacità di viaggiare in tutto il corpo (metastasi). Alcuni batteri e virus possono sfruttare il meccanismo di motilità delle cellule per invadere i nostri corpi. Capire come si muovono le cellule e i filamenti di actina simili a bastoncelli che guidano il processo è la chiave per imparare come arrestare o promuovere la motilità per migliorare la salute umana.
Ora, utilizzando uno dei microscopi più potenti al mondo, scienziati del Sanford Burnham Prebys Medical Discovery Institute (SBP) e dell'Università della Carolina del Nord a Chapel Hill (UNC-Chapel Hill) hanno identificato un denso, nanoscaffold dinamico e disorganizzato di filamenti di actina, simile a un pagliaio, che viene indotto in risposta a un segnale molecolare. Questa è la prima volta che i ricercatori hanno visualizzato direttamente, a livello molecolare, una struttura che viene attivata in risposta a un segnale cellulare, una scoperta chiave che amplia la nostra comprensione di come si muovono le cellule. Lo studio è stato pubblicato su Atti dell'Accademia Nazionale delle Scienze degli Stati Uniti d'America ( PNAS ).
"La microscopia ciroelettronica sta rivoluzionando la nostra comprensione del funzionamento interno delle cellule, "dice Dorit Hanein, dottorato di ricerca, autore senior del documento e professore nel programma di bioinformatica e biologia strutturale presso SBP. "Questa tecnologia ci ha permesso di raccogliere robusti, Immagini 3D di regioni di cellule, simili alla risonanza magnetica, che crea immagini dettagliate del nostro corpo. Siamo stati in grado di visualizzare le cellule nel loro stato naturale, che ha rivelato una nanoarchitettura di actina mai vista prima all'interno della cellula".
Nello studio, gli scienziati hanno utilizzato il microscopio crioelettronico di SBP (Titan Krios), intelligenza artificiale (AI) e approcci di imaging cellulare e computazionale su misura per confrontare immagini su nanoscala di fibroblasti di topo con immagini luminose con marcatura temporale di Rac1 fluorescente. una proteina che regola il movimento cellulare, risposta alla forza o alla tensione (meccanosensing) e all'invasione di agenti patogeni. Questo flusso di lavoro tecnicamente complesso, che ha colmato cinque ordini di grandezza in scala (da decine di micron a nanometri), ha impiegato anni per svilupparsi al suo attuale livello di robustezza e accuratezza ed è stato reso possibile grazie agli sforzi sperimentali e computazionali dei team di biologi strutturali presso SBP e il team di biosensori dell'UNC-Chapel Hill.
Le immagini hanno rivelato un fitto, disorganizzato, struttura simile a un'impalcatura composta da corti bastoncini di actina. Queste strutture sono apparse alla vista in regioni definite in cui è stato attivato Rac1, e si è rapidamente dissipato quando la segnalazione di Rac1 si è interrotta, in appena due minuti e mezzo. Questo scaffold dinamico contrastava nettamente con vari altri gruppi di actina in aree di bassa attivazione di Rac1, alcuni composti da lunghi, bastoncini di actina allineati, e altri costituiti da bastoncini di actina corti che si ramificano dai lati di filamenti di actina più lunghi. Il volume che racchiudeva l'impalcatura di actina era privo di strutture cellulari comuni, come ribosomi, microtubuli, vescicole e altro, probabilmente a causa dell'intensa densità della struttura.
"Siamo rimasti sorpresi dal fatto che esperimento dopo esperimento abbia rivelato questi punti caldi unici di non allineati, bastoncini di actina densamente impacchettati nelle regioni correlate all'attivazione di Rac1, "dice Niels Volkmann, dottorato di ricerca, un autore corrispondente dell'articolo che ha guidato la parte computazionale dello studio, e professore nel programma di bioinformatica e biologia strutturale presso SBP. "Crediamo che questo disturbo sia in realtà il punto di forza dell'impalcatura:garantisce la flessibilità e la versatilità per costruire edifici più grandi, architetture complesse di filamenti di actina in risposta a ulteriori segnali spaziali locali".
Prossimo, gli scienziati vorrebbero espandere il protocollo per visualizzare più strutture create in risposta ad altri segnali molecolari e sviluppare ulteriormente la tecnologia per consentire l'accesso ad altre regioni della cellula.
"Questo studio è solo l'inizio. Ora che abbiamo sviluppato questo flusso di lavoro quantitativo su nanoscala che correla il comportamento della segnalazione dinamica con la risoluzione su nanoscala della criotomografia elettronica, noi e altri scienziati possiamo implementare questo potente strumento analitico non solo per decifrare il funzionamento interno del movimento cellulare, ma anche per chiarire le dinamiche di molte altre macchine macromolecolari in un ambiente cellulare imperturbato, "dice Hanein.
lei aggiunge, "L'actina è una proteina fondamentale; interagisce con più di 150 proteine leganti l'actina per generare diverse strutture, ognuno serve una funzione unica. Abbiamo un surplus di segnali diversi che vorremmo mappare, che potrebbe fornire ancora più informazioni su come si muovono le cellule".