Disegno schematico della fabbricazione delle membrane ingegnerizzate tramite elettrofilatura di PCL e PDA NP. Credito:NPG Asia Materials, doi:10.1038/s41427-019-0139-5
In un nuovo studio ora pubblicato su Materiali NPG Asia , i bioingegneri segnalano lo sviluppo di una nuova membrana fibrosa con cellule staminali per riparare i difetti ossei nei crani dei topi. Per questo, hanno incorporato la proteina polidopamina ispirata ai mitili come composto promettente per legare le sostanze biologiche alle superfici della membrana, proprio come le proteine adesive nelle cozze. Nel lavoro, Yi Deng e un gruppo di ricerca nei dipartimenti interdisciplinari di ingegneria chimica, industria meccanica, tecnologia dei materiali, centro per i materiali futuri e la medicina rigenerativa in Cina e Australia, rivestito le membrane biocompatibili con nanoparticelle di polidopamina per formare molti siti topologici per l'attacco del calcio e la riparazione dei difetti ossei.
Il team ha incubato le membrane non rivestite e rivestite con cellule staminali isolate dal midollo osseo e ha impiantato le membrane per rigenerare i difetti ossei del cranio nei topi vivi. Dopo uno studio traslazionale di 2 mesi, hanno rivelato la capacità delle membrane appiccicose di dirigere le cellule staminali a produrre quantità significativamente maggiori di osso, rispetto alle membrane non rivestite. Difetti e lesioni ossee possono comunemente verificarsi a livello microscopico come difetti congeniti, a causa di incidenti o come malattia degenerativa legata all'età. La maggior parte dei difetti ossei non può essere riparata spontaneamente da meccanismi di autoguarigione che portano all'urgente necessità di sviluppare biomateriali robusti che facilitino la riparazione ossea nella ricerca sulle ossa e nell'ingegneria del tessuto osseo.
I bioingegneri possono manipolare la differenziazione delle cellule staminali per formare osteoblasti maturi tramite la rigenerazione tissutale guidata (GTR) sulle membrane di superficie per ottimizzare, rigenerazione ossea su larga scala. Nella scienza dei materiali e nei materiali funzionali avanzati, le membrane elettrofilate hanno ricevuto enorme attenzione per tali strategie di ingegneria tissutale guidata a causa di numerosi vantaggi biocompatibili, Compreso:
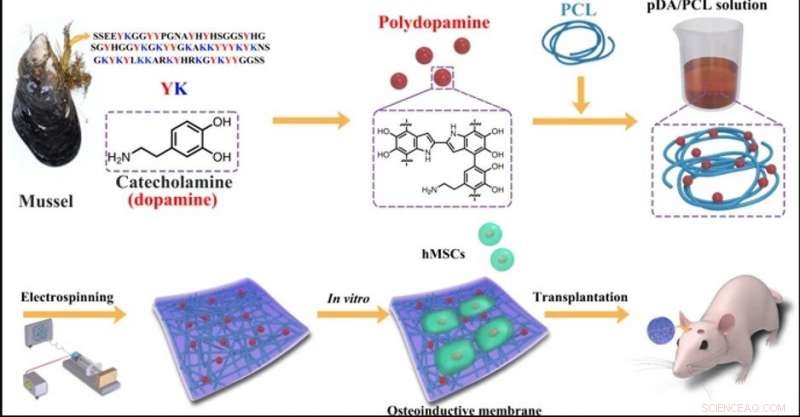
IN ALTO:Micromorfologie di NP PDA e membrane fibrose PDA/PCL elettrofilate. un'immagine TEM di PDA NP; b Immagini SEM del (b1) PCL incontaminato, (b2) 1% PDA/PCL, (b3) 2% PDA/PCL, (b4) 5% PDA/PCL, e (b5) 10% membrane fibrose PDA/PCL. Le frecce rosse in b indicano i filamenti. FONDO:Costituenti chimici delle membrane fibrose PDA/PCL. (a) spettri Raman e (b) angoli di contatto con le corrispondenti immagini delle gocce d'acqua delle membrane fibrose PDA/PCL. Credito:NPG Asia Materials, doi:10.1038/s41427-019-0139-5
Gli scienziati dei materiali classificano i materiali sintetici GTR in due categorie principali come (1) materiali bioriassorbibili e (2) materiali non assorbibili; dove i materiali non assorbibili devono essere rimossi dopo l'impianto tramite un secondo intervento chirurgico, causando un aumento delle spese sanitarie, compromettendo il tessuto appena generato. In contrasto, membrane biodegradabili come alcol polivinilico (PVA), poli (lattide-co-glicolide) (PLGA) o PCL sono preferiti per gli impianti clinici, sebbene complicazioni biologiche abbiano seriamente impedito la loro adozione clinica.
Nel presente lavoro, perciò, Deng et al. ha utilizzato la proteina adesiva bioispirata secreta dalle cozze come rivestimento superficiale "indipendente dal materiale" e facile, strategia ingegneristica basata sulla chimica dei catecoli. La polidopamina (PDA) può facilitare la differenziazione osteoblastica delle cellule staminali su una varietà di substrati come rivestimento di biomateriali su nanoscala, per supportare l'attaccamento delle cellule staminali mesenchimali e indurre la riprogrammazione delle cellule somatiche umane. Tuttavia, I nanostrati di PDA possono facilmente delaminarsi dalle superfici per indurre l'apoptosi cellulare locale o reazioni infiammatorie come effetti avversi. Deng et al. ha implementato specifiche fasi sperimentali per superare i limiti esistenti e sviluppare una nuova membrana biocompatibile e biodegradabile in laboratorio. Il biomateriale di nuova concezione o la membrana fibrosa fornirà una nicchia favorevole per guidare i destini delle cellule staminali locali per formare osteoblasti per la rigenerazione ossea.
Fase uno:progettazione di PCL (PDA/PCL) con PDA incluso con elettrofilatura
Gli scienziati hanno utilizzato la chimica dei catecoli per la fabbricazione e la sintesi di membrane fibrose PDA/PCL. Hanno disperso uniformemente le nanoparticelle PDA (NP) in PCL tramite sonicazione continua e vortex per formare le membrane fibrose tramite elettrofilatura. Deng et al. ha utilizzato un microscopio elettronico a scansione (SEM) e ha osservato le proprietà della superficie del campione casuale, rete fibrosa di dimensioni micron. Comparativamente, le membrane pure in PCL elettrofilate sono rimaste lisce, mentre l'integrazione di PDA NP ha reso ruvide le superfici delle fibre. Gli scienziati hanno confermato la nuova chimica di superficie utilizzando gli spettri Raman e l'analisi della spettroscopia fotoelettronica a raggi X (XPS). I biomateriali erano idrofili e consentivano l'assorbimento delle proteine e l'adesione cellulare. I ricercatori hanno condotto misurazioni dell'angolo di contatto per verificare la bagnabilità della superficie e una migliore idrofilia dopo la modifica del PDA rispetto al puro, membrane PCL non modificate.
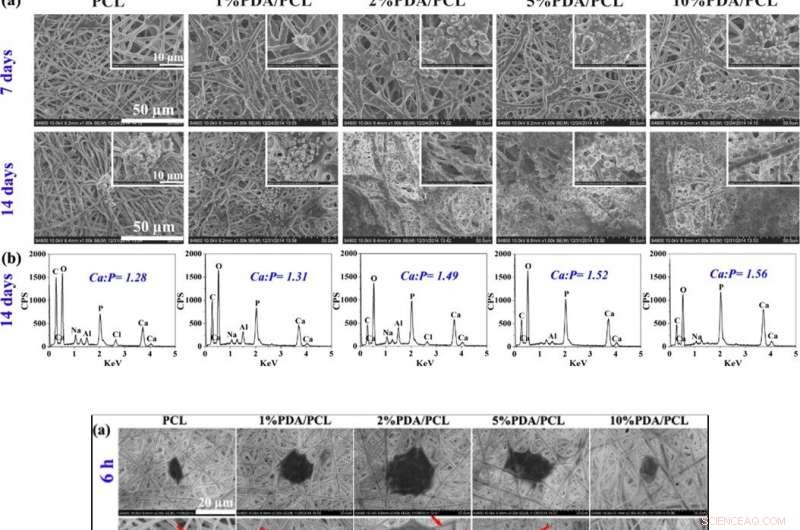
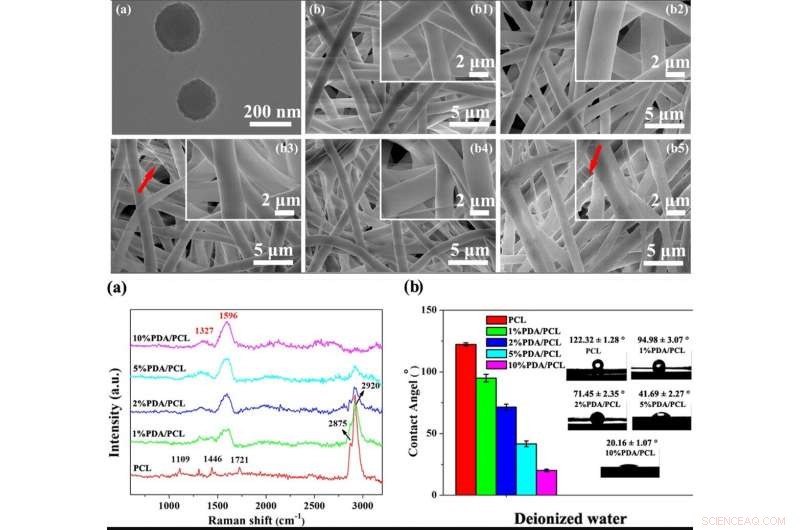
IN ALTO:Formazione di noduli simili all'osso. (a) Fotografie SEM di membrane fibrose PDA/PCL acquisite dopo l'immersione in SBF per 7 e 14 giorni. (b) Dati EDS e rapporti Ca/P dei sedimenti di particelle sulla superficie delle membrane fibrose PDA/PCL a 14 giorni. IN BASSO:Attaccamento cellulare e proliferazione. (a) Osservazione SEM e b CLSM di hMSC aderenti sulle membrane fibrose ingegnerizzate con diverse concentrazioni di PDA NP a 6 e 12 h. Le frecce rosse in un punto agli pseudopodi. Gli inserti in alto a destra di (b) mostrano le immagini ingrandite di una singola cella. (c) Attacco cellulare e (d) curve di proliferazione delle hMSC sulle superfici del campione ottenute tramite CCK-8. * Rappresenta p < 0.05 tra i gruppi, ** rappresenta p < 0.01 tra i gruppi; e # rappresenta p < 0.05 rispetto ad altri gruppi. Credito:NPG Asia Materials, doi:10.1038/s41427-019-0139-5
Fase due:studi di caratterizzazione della superficie
Poiché le membrane bioattive possono integrarsi con il tessuto osseo circostante (tessuto osseo), Deng et al. hanno valutato la formazione di strati di apatite ossea sulla superficie di biomateriali immersi in una soluzione di fluido corporeo simulato (SBF). Dopo 7 giorni di immersione, gli scienziati hanno osservato aggregati nodulari raggruppati sulle membrane PDA/PCL, che è aumentato drammaticamente dal giorno 14. Comparativamente, il campione di controllo di PCL incontaminato non modificato ha mantenuto depositi di Ca-P a sette giorni, con isole di apatite entro il giorno 14. Con l'aumento del contenuto di PDA, perciò, la quantità di apatite depositata sulla superficie è aumentata. Deng et al. ha utilizzato i dati di caratterizzazione del materiale per convalidare la bioattività in vitro potenziata delle membrane PDA/PCL rispetto al controllo PCL puro.
Fase tre:studi di biofunzionalizzazione
Gli scienziati hanno valutato la citocompatibilità (biocompatibilità cellulare) delle membrane PDA/PCL ingegnerizzate rispetto all'adesione cellulare, diffusione, e la proliferazione delle cellule staminali mesenchimali umane (hMSC). Le hMSC esistono in gran parte nel midollo osseo per assistere la riparazione dei tessuti durante le lesioni. Dopo 6 ore di coltura cellulare, le hMSC con forme cellulari rotonde non aderivano bene al PCL puro ma esprimevano filopodi per l'adesione alla superficie della membrana su tre varianti di membrane PDA/PCL. Utilizzando esperimenti di conteggio delle cellule e saggi di vitalità cellulare CCK-8, Deng et al. ha mostrato che il contenuto di NP PDA ha influenzato significativamente il numero di cellule vitali attaccate alla superficie, e hanno osservato proprietà superficiali ottimali con il gruppo PDA/PCL del 2% nel lavoro.
Il team di ricerca ha determinato la formula ottimale per progettare le membrane PDA/PCL per la rigenerazione guidata del tessuto osseo determinando l'attività della fosfatasi alcalina (ALP) e la produzione di matrice di calcio delle hMSC con la colorazione Alizarin Red S (ARS). La crescita cellulare e la differenziazione osteogenica erano basse quando le quantità di NP PDA erano alte o basse, perché basse concentrazioni non hanno innescato la crescita cellulare, considerando che alte concentrazioni erano tossiche nello studio.
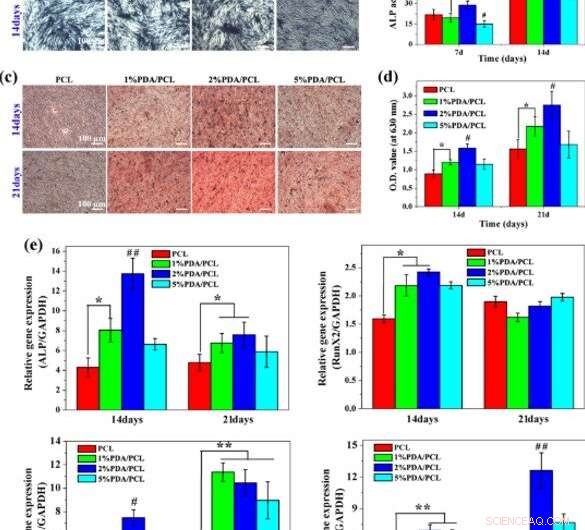
Differenziazione osteogenica:a, b Colorazione e quantificazione dell'attività ALP, C, d Colorazione ARS e quantificazione della produzione di calcio, e e analisi RT-PCR per geni osteo-specifici su differenti membrane fibrose PDA/PCL. * rappresenta p < 0.05 tra i gruppi, **rappresenta p < 0.01 tra i gruppi. # rappresenta p < 0.05 rispetto ad altri gruppi, e ## rappresenta p < 0.05 rispetto ad altri gruppi. Credito:NPG Asia Materials, doi:10.1038/s41427-019-0139-5
Poiché le indagini a livello molecolare sono un potente strumento nei biomateriali per la bioingegneria, Deng et al. ha studiato l'interazione tra hMSC e membrane ingegnerizzate utilizzando strumenti molecolari. Per questo, hanno monitorato l'espressione dei geni correlati all'osteogenesi ALP, Eseguix2, Col1a1 e OPN in hMSC coltivate sulle membrane. A 7 giorni hanno osservato livelli sostanziali di espressione del gene ALP sul campione del 2% di PDA/PCL.
Entro il giorno 14, il livello del gene Runx2 espresso sull'1 e 2% dei gruppi PDA/PCL superava significativamente il gruppo PCL puro. Però, entro 21 giorni, gli scienziati non hanno osservato una differenza distinguibile tra i quattro gruppi. Hanno verificato le osservazioni utilizzando la colorazione dell'immunofluorescenza e hanno scelto le membrane PDA/PCL al 2% per l'induzione ottimale delle hMSC per differenziarsi in osteoblasti maturi.
Fase quattro:studio traslazionale
Guidati dai dati degli esperimenti in vitro, Deng et al. ha studiato la biofunzionalità in vivo della membrana microfibrosa utilizzando un modello animale. Per questo, hanno creato difetti ossei di dimensioni critiche sui crani dei topi e hanno posizionato membrane fibrose per coprire i difetti, seguito da test di formazione ossea mediante tomografia microcomputerizzata (micro-TC), analisi istologiche e marcatura fluorescente; da quattro a otto settimane dopo l'impianto.
Quando hanno esaminato le immagini 3D dei crani micro-CT, la membrana PDA/PCL al 2% offriva le aree più ampie di nuova formazione ossea, con notevole espansione al centro del difetto osseo. Gli scienziati hanno ottenuto un contenuto più elevato di matrice calcificata e rimodellamento osseo nelle membrane PDA/PCL al 2% per un'integrazione osteoconduttiva fenomenale.
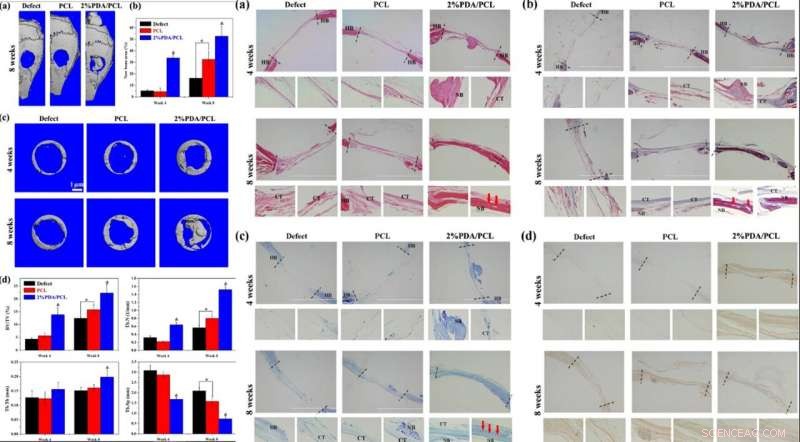
A SINISTRA:Valutazione in vivo delle membrane fibrose PDA/PCL. (a) Immagini micro-TC 3D ricostruite di crani interi dopo l'intervento chirurgico a 8 settimane. (b) Quantificazione di nuove aree ossee a 4 e 8 settimane. (c) Immagini micro-TC dei difetti e d istomorfometria ossea di impianti di membrana analizzati dai dati micro-TC dopo 4 e 8 settimane. * rappresenta p < 0.05 tra i gruppi, e &rappresenta p < 0.05 rispetto ad altri gruppi. A DESTRA:Analisi istologica e immunoistologica Analisi istologica e immunoistologica delle sezioni per soli difetti cranici e difetti impiantati con membrane fibrose PCL e 2% PDA/PCL a 4 e 8 settimane dopo l'impianto:(a) colorazione H&E, (b) colorazione di Masson, (c) colorazione con blu di toluidina, (d) e colorazione immunoistologica di OCN. osso ospite HB; tessuto connettivo TC; NB osso neoformato. Le frecce rosse in a–c indicano il vaso sanguigno. Credito:NPG Asia Materials, doi:10.1038/s41427-019-0139-5
La colorazione con ematossilina ed eosina (H&E) ha rivelato tessuto fibroso nelle cavità del gruppo PCL, con una ristrutturazione ossea relativamente visibile nel gruppo PDA/PCL al 2%. Gli scienziati hanno anche osservato un'abbondante vascolarizzazione ossea dopo 8 settimane dall'operazione nel 2% dei gruppi PDA/PCL. Hanno condotto un'ulteriore colorazione con Masson, blu di toluidina e colorazione immunoistochimica (IHC) per identificare in profondità la formazione di nuovo osso e collagene. I dati istologici combinati hanno rivelato che l'impiego di PDA NP nelle membrane fibrose ingegnerizzate aumenta significativamente la rigenerazione ossea, supportando l'ipotesi che l'osteodifferenziazione in vitro fosse efficace anche in vivo.
In questo modo, Yi Deng e collaboratori hanno bioingegnerizzato PDA co-elettrofilati NP con un polimero sintetico bioinerte per costruire bioispirati, membrane fibrose PDA/PCL flessibili e osteopromotive per applicazioni di ingegneria del tessuto osseo nella medicina rigenerativa. La quantità di PDA NP inclusi nel composito ha migliorato significativamente la composizione chimica, dimensione delle fibre e proprietà meccaniche delle membrane sviluppate. Sia gli esperimenti in vitro che i dati in vivo hanno convalidato la capacità di nuova formazione ossea con costrutti PDA/PCL al 2% rispetto al PCL puro. Le membrane PCL/PDA ingegnerizzate sono osteoconduttive e facili da trapiantare con un grande potenziale per le applicazioni GTR.
© 2019 Scienza X Rete