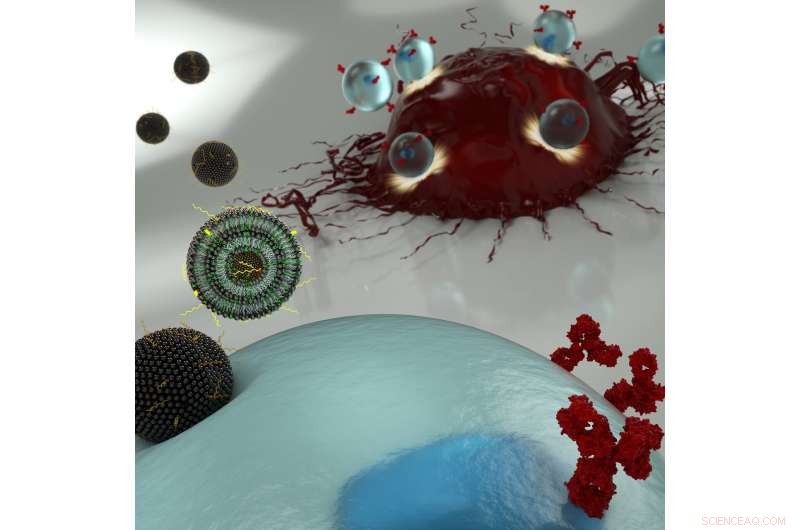
Illustrazione artistica di nanoparticelle che trasportano mRNA in una cellula T (blu), permettendo a quest'ultimo di esprimere recettori di superficie che riconoscono le cellule cancerose (rosso). Credito:Ryan Allen, Second Bay Studios
Le nuove immunoterapie contro il cancro comportano l'estrazione delle cellule T di un paziente e l'ingegneria genetica in modo che riconoscano e attacchino i tumori. Questa tecnica è una vera svolta medica, con un numero crescente di pazienti affetti da leucemia e linfoma che hanno sperimentato remissioni complete da quando la terapia CAR T è stata approvata dalla FDA nel 2017.
Questo tipo di terapia non è esente da sfide, però. L'ingegneria delle cellule T di un paziente è laboriosa e costosa. E quando ha successo, le alterazioni del sistema immunitario fanno immediatamente ammalare gravemente i pazienti per un breve periodo di tempo, con sintomi tra cui febbre, nausea ed effetti neurologici.
Ora, I ricercatori dell'Università della Pennsylvania hanno dimostrato una nuova tecnica ingegneristica che, perché è meno tossico per le cellule T, potrebbe attivare un meccanismo diverso per alterare il modo in cui riconoscono il cancro.
I cicli di trattamento con cellule T che utilizzano questo meccanismo potrebbero avere meno effetti collaterali per i pazienti.
La nuova tecnica ingegneristica dei ricercatori prevede il trasporto di RNA messaggero (mRNA) attraverso la membrana della cellula T tramite una nanoparticella a base di lipidi, piuttosto che usare un virus HIV modificato per riscrivere il DNA della cellula. Sarebbe preferibile utilizzare il primo approccio, in quanto conferisce solo un cambiamento temporaneo al sistema immunitario del paziente, ma l'attuale metodo standard per far passare l'mRNA oltre la membrana cellulare può essere troppo tossico per essere utilizzato sul numero limitato di cellule T che possono essere estratte da un paziente.
I ricercatori hanno dimostrato la loro tecnica in uno studio pubblicato sulla rivista Nano lettere . Era guidato da Michael Mitchell, Skirkanich Assistant Professor of Innovation nel Dipartimento di Bioingegneria della Penn's School of Engineering and Applied Science, e Margaret Billingsley, uno studente laureato nel suo laboratorio.
Hanno collaborato con uno dei pionieri della terapia CAR T:Carl June, il Richard W. Vague Professor in Immunotherapy e direttore del Center for Cellular Immunotherapies presso l'Abramson Cancer Center e il direttore del Parker Institute for Cancer Immunotherapy presso la Perelman School of Medicine di Penn.
La terapia CAR T prevede l'ingegnerizzazione delle cellule T del paziente in modo che esprimano recettori chimerici per l'antigene, la "CAR" di "CAR T, " sulle loro superfici. Questi recettori consentono alle cellule T di riconoscere le cellule cancerose come invasori estranei e di eliminarle dal corpo. Le attuali tecniche di ingegneria comportano la rimozione di un numero di cellule T di un paziente, riscrivendo il loro DNA con un virus in modo che esprimano queste CAR, quindi iniettandoli nuovamente nel paziente.
"Questo metodo di ingegneria virale produce cellule T con espressione CAR permanente, ma questo porta a gravi effetti negativi, poiché le cellule CAR T rimangono attive nel paziente anche dopo l'eradicazione delle cellule tumorali, " dice Billingsley. "Usando l'mRNA per generare cellule T CAR, però, crea cellule T con espressione CAR transitoria. Ciò potrebbe consentire ai medici di somministrare terapie cellulari CAR T in dosi per colpire le cellule tumorali senza danneggiare il maggior numero di cellule sane nel processo, mitigando così gli effetti collaterali”.
Tale approccio non ha ancora acquisito trazione clinica, poiché i metodi per ottenere l'mRNA nelle cellule T sono ancora limitati. La norma attuale, elettroporazione, che comporta la perforazione della membrana cellulare con un impulso elettrico, non è un'opzione attraente, poiché il processo altamente invasivo ha un alto rischio di uccidere la cellula T o di influire sulla sua funzionalità. Anche se ottimizzato, l'elettroporazione spesso provoca la morte cellulare nel 50 percento delle cellule durante il processo di fabbricazione delle cellule.
Visto il costo, difficoltà e interessi associati all'acquisizione di queste cellule da un paziente CAR T, è necessario un metodo molto meno tossico per introdurre l'mRNA prima che questa tecnica diventi una valida alternativa all'approccio di modifica del DNA.
Mitchell, Billingsley e i loro colleghi hanno quindi deciso di trovare una piattaforma di consegna adatta per far passare di nascosto l'mRNA oltre la membrana della cellula T in quantità sufficienti per essere tradotti nelle proteine del recettore desiderate.
Però, poiché le cellule T non assorbono facilmente materiale dal loro ambiente, trovare la nanoparticella giusta per questa applicazione è stata una sfida. Ulteriore, sarebbe fondamentale che la piattaforma includa sia una consegna altamente efficiente che una bassa citotossicità, una combinazione rara.
"Quando si fornisce mRNA terapeutico nelle cellule, devi sempre bilanciare la potenza con effetti collaterali tossici, " dice Mitchell. "Il nostro laboratorio ingegnerizza nanoparticelle lipidiche ionizzabili che possono attraversare in sicurezza le membrane cellulari, ma rilascia mRNA terapeutico specificamente quando deve essere rilasciato. Lo vediamo come un enorme vantaggio, come l'attuale standard clinico, elettroporazione, uccide gran parte delle cellule T del paziente".
"Per di più, " lui dice, "immaginiamo come una piattaforma tecnologica per la consegna di cellule T, poiché possiamo creare mRNA per diversi CAR terapeutici, o altri recettori terapeutici, molto rapidamente semplicemente alterando la sequenza dell'mRNA, e quindi avere una varietà di applicazioni terapeutiche."
Con esperimenti in vitro, i ricercatori hanno dimostrato che le loro nanoparticelle hanno generato cellule T CAR che erano efficaci nell'uccidere le cellule tumorali quanto le cellule T CAR prodotte mediante ingegneria virale attualmente in uso clinico. I prossimi passi includeranno studi in vivo sugli impatti di questo sistema di somministrazione, esaminando gli effetti dell'espressione transitoria di CAR sull'efficacia terapeutica e sugli effetti collaterali.
"Data la crescente cassetta degli attrezzi delle terapie dell'RNA, la consegna di nanoparticelle di RNA ha ampie applicazioni per l'ingegneria delle cellule T, tra cui l'editing genetico del DNA delle cellule T e la modulazione dell'espressione proteica, "dice giugno.