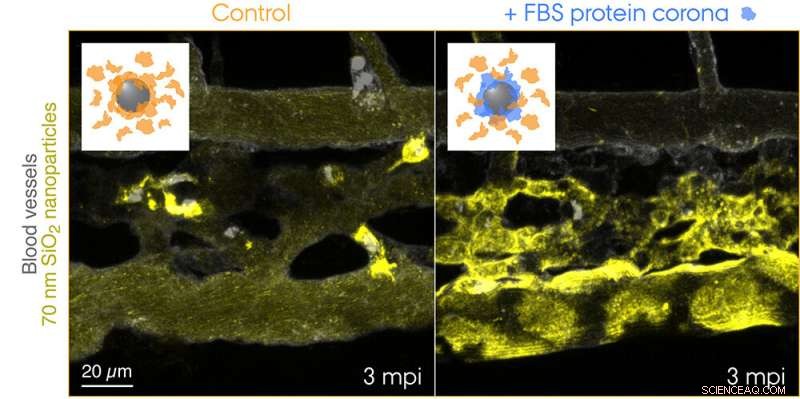
Nanoparticelle di SiO2 da 70 nm marcate con fluorescenza sono state iniettate nel flusso sanguigno di embrioni di zebrafish transgenici di 3 giorni e riprese dal vivo a 3 minuti dopo l'iniezione. I riquadri mostrano schemi per le due condizioni testate:nanoparticelle di controllo con una corona di proteine endogene (arancione) e nanoparticelle con una corona preformata di proteine del siero fetale bovino (FBS) (blu) e proteine endogene aggiuntive. Le nanoparticelle di controllo vengono rapidamente catturate dai macrofagi, mentre le nanoparticelle con un'identità biologica non self sono efficacemente sequestrate dalle cellule endoteliali scavenger. Credito:Yuya Hayashi. Adattato da Mohammad-Beigi et al. (2020) ACS Nano. Copyright 2020 Società Chimica Americana
Una varietà di nanoparticelle è progettata per la somministrazione mirata di farmaci, ma purtroppo solo una piccolissima percentuale delle nanoparticelle iniettate raggiunge il sito bersaglio come i tumori solidi. Il motivo alla base della bassa efficienza di puntamento è spesso considerato una "scatola nera" ed è stato quindi poco esplorato per molti anni.
Recentemente, un team di ricerca internazionale guidato da Yuya Hayashi del Dipartimento di Biologia Molecolare e Genetica (MBG), Università di Aarhus, ha dimostrato la bellezza degli embrioni di zebrafish in nano-bioimaging che può visualizzare interazioni dinamiche tra nanoparticelle e cellule di interesse in un organismo vivente (vedi un altro articolo "Zebrafish ti fa vedere il destino biologico delle nanoparticelle in vivo").
Ora, collaborando con i ricercatori dell'Interdisciplinary Nanoscience Center (iNANO), Yuya cerca di rispondere ai misteri irrisolti della bionanoscienza:il primo in linea è il concetto di identità biologica, il che spiega come le cellule riconoscano le nanoparticelle attraverso una "corona" di proteine che circondano ciascuna particella. Questo concetto è stato ora dimostrato per la prima volta in un organismo vivente mediante l'uso di embrioni di zebrafish scoprendo cosa succede alle nanoparticelle iniettate nel sangue.
Amico o nemico? Come i sistemi biologici riconoscono le nanoparticelle
"What the Cell Sees in Bionanoscience" è una delle prime pubblicazioni che ha definito come si forma una corona di proteine attorno a una nanoparticella e come tale corona proteica implichi la necessità di ripensare il modo in cui guardiamo alle nanoparticelle all'interno di un ambiente biologico. Da un'ampia ricerca nell'ultimo decennio, ora capiamo che due effetti opposti contribuiscono principalmente all'assorbimento delle nanoparticelle da parte delle cellule. Generalmente, la corona proteica impedisce alla superficie delle nanoparticelle di interazioni fisiche dirette con la membrana cellulare. Però, cosa succede se la corona proteica presenta un segnale che innesca una specifica interazione biologica con i recettori dispiegati sulla membrana cellulare? Questo è qualcosa che la cellula vede e quindi conferisce un'identità biologica alla nanoparticella.
Ora i ricercatori dell'Università di Aarhus hanno quindi fornito la prima prova "visiva" del notevole contributo della corona proteica alla rimozione delle nanoparticelle dal sangue che ha comportato esiti negativi nel modello di embrione di zebrafish. Il team di ricerca ha utilizzato una fonte di proteine non corrispondente alla specie per la formazione della corona per creare un'identità biologica "non-sé" e ha tracciato il viaggio delle nanoparticelle che viaggiano attraverso il sangue e verso la loro destinazione finale:gli endolisosomi nella cellula. Ciò ha rivelato un assorbimento e un'acidificazione sorprendentemente rapidi delle nanoparticelle da parte delle cellule endoteliali scavenger (equivalente funzionale delle cellule endoteliali sinusoidali del fegato nei mammiferi) seguite dall'attivazione pro-infiammatoria dei macrofagi (vedi il filmato nella pagina web del gruppo di Yuya).
"Sembra un'idea folle iniettare nanoparticelle con proteine di un altro animale, "dice Yuya, "ma per esempio le nanomedicine ispirate alle biomolecole sono testate in un modello murino senza particolari preoccupazioni per la combinazione di specie non corrispondente. Oppure alcune persone intelligenti umanizzano il topo per occuparsi del problema della compatibilità delle specie. Infatti, anche a livello di coltura cellulare le nanoparticelle sono ancora regolarmente testate seguendo la tradizione di utilizzare integratori di siero derivati da mucche pur sapendo che le interazioni nanoparticelle-proteina sono un fattore chiave per l'assorbimento cellulare".
"Ciò che rende questo tipo di esperimenti piuttosto impegnativo è, " aggiunge il primo autore Hossein Mohammad-Beigi, "per mantenere al massimo la corona proteica originale in un organismo vivente. Se la corona preformata viene rapidamente scambiata dalle proteine del sangue endogene, l'ipotesi testata diventa invalida. Abbiamo fatto parecchi sforzi per caratterizzare la corona proteica per garantire che le nanoparticelle conservino l'identità biologica non autosufficiente".
Provare per credere:il modello del pesce zebra può offrire ciò che i modelli di roditore non possono offrire
Il più grande vantaggio del modello zebrafish è la sua potenza nell'imaging multicolore in tempo reale, per cui più combinazioni di traccianti di fluorescenza e proteine reporter possono essere visualizzate in una semplice configurazione ad alta risoluzione spazio-temporale. Ciò fornisce una nuova opportunità che si trova tra i sistemi di coltura cellulare meno realistici e gli esperimenti sui roditori più impegnativi come la microscopia intravitale.
"Utilizzando colture cellulari, abbiamo imparato molto su come le cellule riconoscono le nanoparticelle piuttosto come aggregati dinamici di proteine, ma non è mai stato testato in una situazione più realistica, " Yuya spiega. "Con l'istituzione del modello zebrafish, abbiamo finalmente acquisito un mezzo per esplorare ulteriormente questa domanda in un organismo vivente. È stato un approccio semplice con uno scenario estremo testato in un sistema molto complesso, ma credo che ora siamo un passo più vicini alla comprensione di cosa può realmente significare la corona proteica per le nanoparticelle. In un ambiente ricco di proteine, le nanoparticelle possono indossare una maschera che conferisce loro un'identità biologica, e la sua non-sé può renderli nemici. Cosa definisce il grado di non-sé? Bene, è la prossima grande domanda che dobbiamo affrontare".