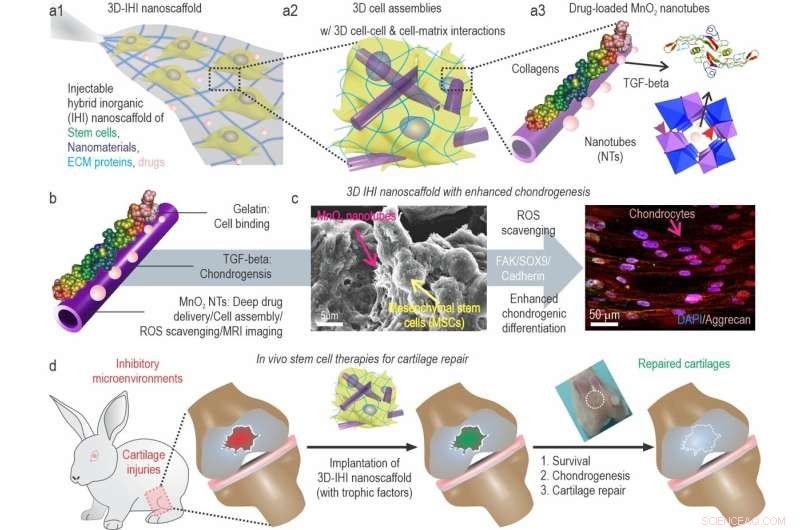
a) Un'illustrazione schematica del nanoscaffold 3D TGFβ-BMSC-IHI. b) L'illustrazione schematica di MnO2 rivestito di gelatina e caricato con TGF-β3 NT. c) L'immagine FESEM indicava che la maggior parte dei BMSC forma contatti con altre cellule e le strutture simili a fibrille 1D, che era simile alle strutture dei tessuti naturali. d) Rimodellando il microambiente ossidativo, migliorando la vitalità cellulare e la condrogenesi delle cellule trapiantate, si potrebbe finalmente ottenere la rigenerazione della cartilagine. Credito:Science China Press
Uno studio guidato dal Prof. Qiuyu Zhang (Northwestern Polytechnical University), dal Prof. Ki-Bum Lee (Rutgers University) e dal Prof. Liang Kong (School of Stomatology, The Fourth Military Medical University) ha stabilito un ibrido inorganico iniettabile (IHI) assemblaggio di cellule staminali modellate su nanoscaffold e l'hanno applicato alla rigenerazione di difetti della cartilagine di dimensioni critiche.
Le lesioni della cartilagine sono spesso devastanti e la maggior parte di esse non ha cure a causa della capacità di rigenerazione intrinsecamente bassa dei tessuti cartilaginei. L'ascesa dei sistemi di coltura di cellule staminali 3D ha portato a innovazioni nella biologia dello sviluppo, nella modellazione delle malattie e nella medicina rigenerativa. Ad esempio, le cellule staminali, una volta trapiantate con successo, potrebbero inizialmente secernere fattori trofici per ridurre l'infiammazione nei siti di lesioni della cartilagine e quindi differenziarsi in cellule della cartilagine (ad esempio, condrociti) per il ripristino funzionale.
Ciononostante, restano ancora ostacoli critici da superare prima che il potenziale terapeutico delle terapie con cellule staminali possa essere realizzato. Il controllo limitato sulla differenziazione condrogenica delle cellule staminali in vivo ha spesso portato a risultati rigenerativi compromessi. Inoltre, a causa della prevalenza dello stress ossidativo e dell'infiammazione nel microambiente dei siti di lesione, le cellule staminali subiscono frequentemente l'apoptosi dopo l'iniezione.
Per affrontare queste sfide, i ricercatori hanno dimostrato lo sviluppo di un sistema di assemblaggio di cellule staminali 3D IHI basato su modelli di nanoscaffold per colture e impianti avanzati di cellule staminali 3D. Il nanoscaffold 3D-IHI assembla rapidamente le cellule staminali in costrutti di tessuto iniettabili attraverso interazioni cellula-cellula e cellula-matrice 3D su misura, fornisce proteine condrogeniche in modo profondo e omogeneo nei sistemi di coltura 3D assemblati e induce in modo controllabile la condrogenesi attraverso effetti nanotopografici.
Una volta impiantato in vivo in un modello di lesione della cartilagine di coniglio, il nanoscaffold 3D-IHI modula efficacemente il microambiente dinamico dopo la lesione della cartilagine attraverso l'integrazione dei suddetti segnali rigenerativi e contemporaneamente elimina le specie reattive dell'ossigeno utilizzando una composizione a base di biossido di manganese. In questo modo si realizza una riparazione accelerata dei difetti cartilaginei con una rapida ricostruzione dei tessuti e un recupero funzionale sia a breve che a lungo termine. Data l'eccellente versatilità e il risultato terapeutico della rigenerazione della cartilagine basata su nanoscaffold 3D-IHI, potrebbe fornire mezzi promettenti per far avanzare una varietà di applicazioni di ingegneria tissutale.
La ricerca è stata pubblicata su National Science Review .
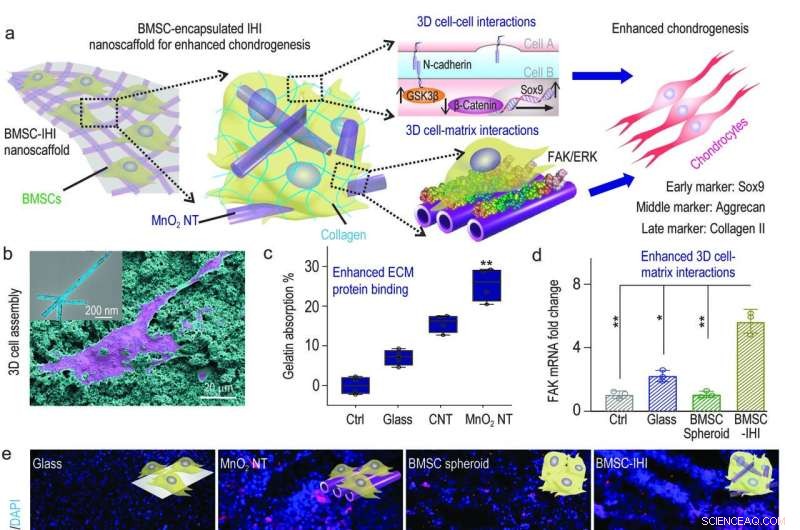
a) Un diagramma schematico che mostra il nanoscaffold 3D-IHI potrebbe migliorare la differenziazione condrogenica di BMSC attraverso una sinergia tra N-caderina e percorsi mediati da FAK. b) Le forti interazioni tra MnO2 NT e gruppi funzionali comunemente esistenti nelle proteine ECM hanno supportato efficacemente l'attaccamento cellulare, come dimostrato tramite l'immagine SEM. c) Il test dell'acido bicinconinico ha indicato il maggiore assorbimento verso la gelatina da MnO2 nanotubo rispetto ai gruppi di controllo. d) Il MnO2 nanotube-templated assembly method significantly enhanced cell-matrix interaction as demonstrated through the up-regulated expression patterns of the FAK gene. e) Representative immunostaining images showing the improved chondrogenesis of BMSC in the BMSC-IHI nanoscaffold group compared to the control groups. Barra della scala:50 μm. f-h) The expression of chondrogenic genes, including SOX9 (f), Aggrecan (g), and Col-II (h) were characterized via qRT-PCR measurement. Credito:Science China Press
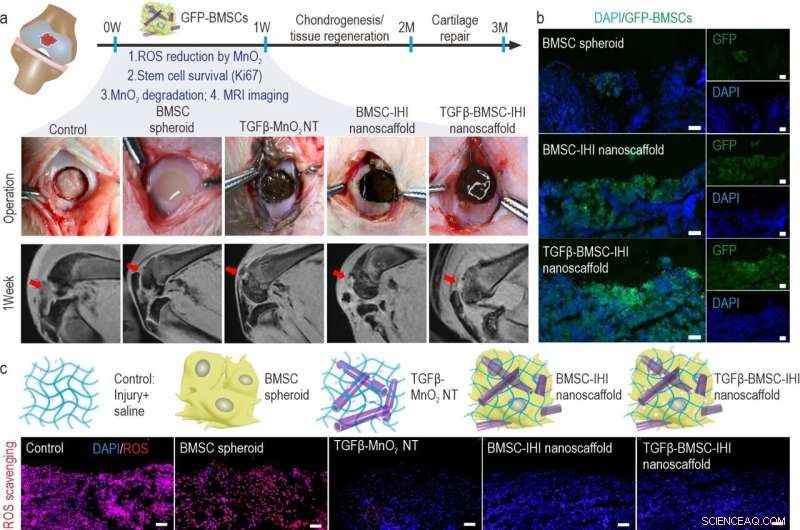
a) Schematic diagram illustrating the surgical process and timeline of cartilage repair. The degradation of MnO2 NTs and the regeneration process could be monitored via MRI. b) To identify our transplanted cells, BMSCs were genetically labeled with a green fluorescent protein (GFP). Scale bar:100 μm. c) The dramatically reduced red fluorescent signals of the ROS probe revealed that MnO2 NTs in the IHI nanoscaffold could effectively scavenge ROS in the defect area. Promoted cell proliferation was confirmed by the higher expression of proliferative marker Ki67 immunostaining. Barra della scala:50 μm. d) The TGFβ-BMSC-IHI nanoscaffold could retain a significantly higher amount of cells after transplantation compared to other cell transplantation groups by quantifying the number of remaining GFP+ cells in (c). e) Histogram of the fluorescence intensity of ROS probe showed the effective consumption of ROS in the MnO2 NTs containing groups. f) Quantification of Ki67+ cells in the defects. The quantifications in (e) and (f) were generated based on the fluorescence intensities in (c). Credito:Science China Press
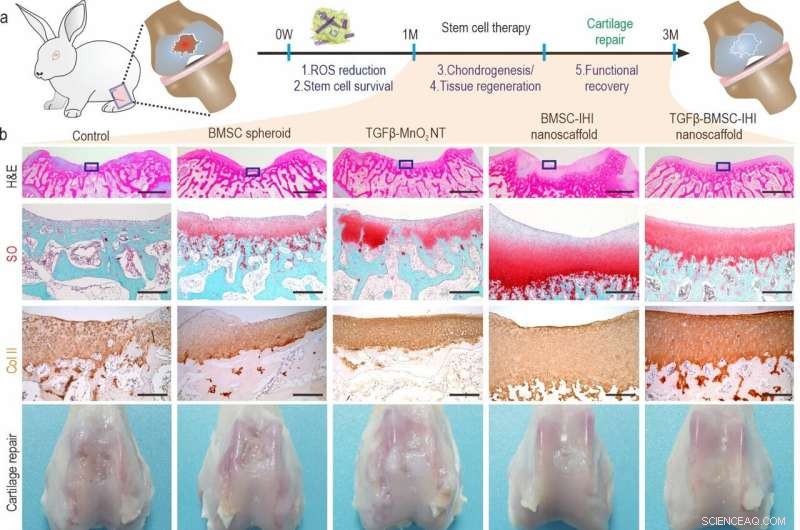
a) A schematic diagram illustrating the long-term (3 months) cartilage regeneration process. b) The in vivo cartilage regeneration was characterized through H&E, Safranin O staining, Col-II immunochemistry staining, as well as macroscopic views. Zoom out scale bar:2 mm, zoom in scale bar:200 μm. c-h) Quantifications of cartilage thickness (by H&E staining) (c), cellular components (by Safranin O staining) (d), ECM components (by Col II immunostaining) (e). Results of International Cartilage Repair Society (ICRS) macroscopic (f) and histologic scores (g) indicated significantly improved defect repair qualities in the TGFβ-BMSC-IHI nanoscaffold group. The reduced Osteoarthritis Research Society International (OARSI) scores revealed the TGFβ-BMSC-IHI nanoscaffold could prevent the deterioration of osteoarthritis (h). Credito:Science China Press