È possibile coltivare tessuti in laboratorio, ad esempio per sostituire la cartilagine danneggiata? Alla TU Wien (Vienna), è stato ora compiuto un passo importante verso la creazione di tessuto sostitutivo in laboratorio, utilizzando una tecnica che differisce significativamente da altri metodi utilizzati in tutto il mondo. Lo studio è pubblicato su Acta Biomaterialia .
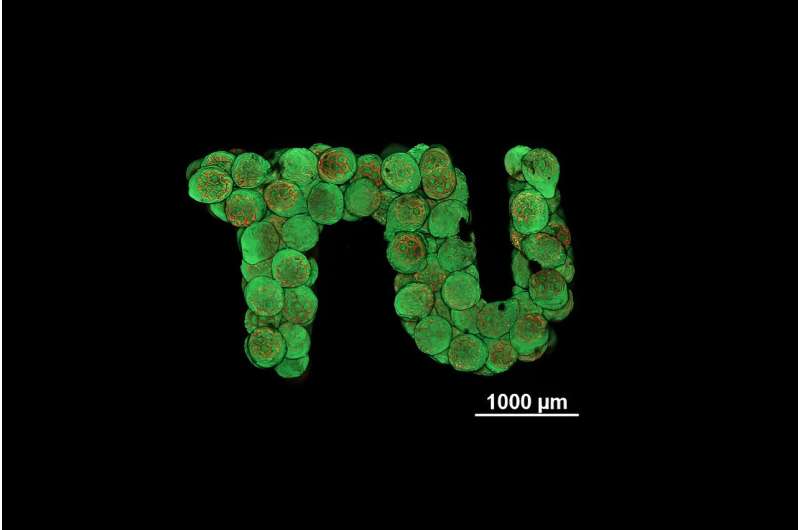
Uno speciale processo di stampa 3D ad alta risoluzione viene utilizzato per creare minuscole sfere porose realizzate in plastica biocompatibile e degradabile, che vengono poi colonizzate da cellule. Questi sferoidi possono quindi essere disposti secondo qualsiasi geometria e le cellule delle diverse unità si combinano perfettamente per formare un tessuto vivente uniforme. Il tessuto cartilagineo, con il quale il concetto è stato ora dimostrato alla TU Wien, era precedentemente considerato particolarmente impegnativo sotto questo aspetto.
"Coltivare cellule cartilaginee da cellule staminali non è la sfida più grande. Il problema principale è che di solito si ha poco controllo sulla forma del tessuto risultante", afferma Oliver Kopinski-Grünwald dell'Istituto di scienza e tecnologia dei materiali della TU Wien, uno degli autori del presente studio. "Ciò è dovuto anche al fatto che tali gruppi di cellule staminali cambiano forma nel tempo e spesso si restringono."
Per evitare ciò, il gruppo di ricerca della TU Wien sta lavorando con un nuovo approccio:sistemi di stampa 3D ad alta risoluzione basati su laser appositamente sviluppati vengono utilizzati per creare minuscole strutture simili a gabbie che sembrano mini palloni da calcio e hanno un diametro di appena un terzo di un millimetro. Fungono da struttura di supporto e formano blocchi compatti che possono poi essere assemblati in qualsiasi forma.
Le cellule staminali vengono prima introdotte in queste mini-gabbie a forma di pallone da calcio, che riempiono rapidamente completamente il minuscolo volume. "In questo modo possiamo produrre in modo affidabile elementi tissutali in cui le cellule sono distribuite uniformemente e la densità cellulare è molto elevata. Ciò non sarebbe stato possibile con gli approcci precedenti", spiega il Prof. Aleksandr Ovsianikov, responsabile del reparto Stampa 3D e biofabbricazione gruppo di ricerca presso la TU Vienna.

Crescere insieme perfettamente
Il team ha utilizzato cellule staminali differenziate, ovvero cellule staminali che non possono più svilupparsi in nessun tipo di tessuto, ma sono già predeterminate per formare un tipo specifico di tessuto, in questo caso il tessuto cartilagineo. Tali cellule sono particolarmente interessanti per le applicazioni mediche, ma la costruzione di tessuti più grandi è impegnativa quando si tratta di cellule cartilaginee. Nel tessuto cartilagineo, le cellule formano una matrice extracellulare molto pronunciata, una struttura a rete tra le cellule che spesso impedisce ai diversi sferoidi cellulari di crescere insieme nel modo desiderato.
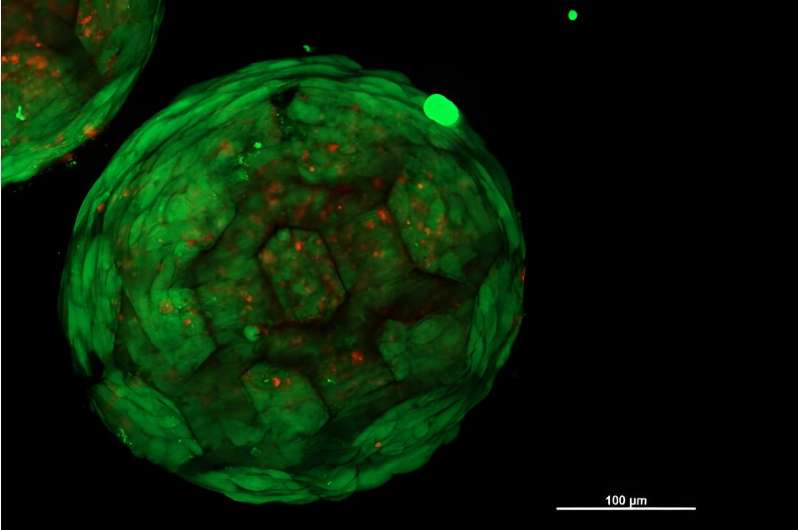
Se gli sferoidi porosi stampati in 3D vengono colonizzati con cellule nel modo desiderato, gli sferoidi possono essere disposti in qualsiasi forma desiderata. La domanda cruciale ora è:anche le cellule di diversi sferoidi si combinano per formare un tessuto uniforme e omogeneo?
"Questo è esattamente ciò che abbiamo potuto mostrare per la prima volta", afferma Kopinski-Grünwald. "Sotto il microscopio si può vedere molto chiaramente:sferoidi vicini crescono insieme, le cellule migrano da uno sferoide all'altro e viceversa, si collegano senza soluzione di continuità e danno come risultato una struttura chiusa senza cavità, a differenza di altri metodi che sono stati testati. utilizzato finora, in cui rimangono interfacce visibili tra gruppi cellulari vicini."
Le minuscole impalcature stampate in 3D conferiscono stabilità meccanica alla struttura complessiva mentre il tessuto continua a maturare. Nel giro di pochi mesi, le strutture plastiche si degradano, semplicemente scompaiono, lasciando dietro di sé il tessuto finito con la forma desiderata.
Primo passo verso l'applicazione medica
In linea di principio, il nuovo approccio non si limita al tessuto cartilagineo, ma potrebbe essere utilizzato anche per personalizzare diversi tipi di tessuti più grandi, come il tessuto osseo. Tuttavia, ci sono ancora alcuni compiti da risolvere lungo il percorso:dopo tutto, a differenza del tessuto cartilagineo, per questi tessuti al di sopra di una certa dimensione dovrebbero essere incorporati anche vasi sanguigni.
"Un obiettivo iniziale sarebbe quello di produrre piccoli pezzi di tessuto cartilagineo su misura che possano essere inseriti nel materiale cartilagineo esistente dopo un infortunio", afferma Oliver Kopinski-Grünwald. "In ogni caso, ora siamo stati in grado di dimostrare che il nostro metodo per produrre tessuto cartilagineo utilizzando micro-scaffold sferici funziona in linea di principio e presenta vantaggi decisivi rispetto ad altre tecnologie."
Ulteriori informazioni: Oliver Kopinski-Grünwald et al, Sferoidi impalcati come elementi costitutivi per l'ingegneria dei tessuti cartilaginei dal basso verso l'alto mostrano dinamiche di bioassemblaggio migliorate, Acta Biomaterialia (2023). DOI:10.1016/j.actbio.2023.12.001
Fornito dall'Università della Tecnologia di Vienna