Un cambiamento nella conformazione del sito attivo trasforma il citocromo c da una navetta di elettroni nella respirazione a un enzima perossidasi per l'apoptosi. Credito:(c) Scienza 23 giugno 2017:vol. 356, Numero 6344, pagg. 1236, DOI:10.1126/science.aan5587
(Phys.org)—Un team di ricercatori della Stanford University ha utilizzato la spettroscopia di assorbimento ed emissione di raggi X ultraveloce per quantificare lo stato entatico del citocromo c. Nel loro articolo pubblicato sulla rivista Scienza , il gruppo delinea la loro procedura e ciò che hanno appreso. Kara Bren ed Emma Raven con l'Università di Rochester e l'Università di Leicester offrono rispettivamente un pezzo di prospettiva sul lavoro svolto dal team nello stesso numero della rivista, e delineare alcune delle implicazioni riguardanti il ruolo che la proteina svolge nella vita e nella morte cellulare.
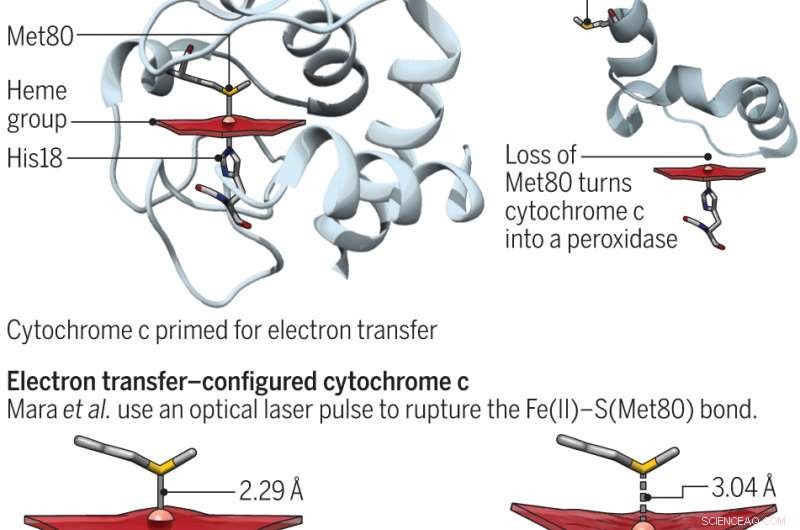
Il citocromo c è una proteina presente in molte piante, animali e organismi unicellulari. Negli umani, i suoi scopi principali sono il trasporto di elettroni nei mitocondri e l'assistenza all'apoptosi (la morte cellulare normale e i processi che la circondano). Queste due funzioni sono state dimostrate in precedenti tentativi di fare affidamento sulla posizione del residuo di metionina. Quando lo zolfo lavora con il ferro, la proteina è pronta a trasferire gli elettroni. Altrimenti, si impegna in attività perossidasi. In questo nuovo sforzo, i ricercatori hanno cercato di comprendere meglio l'energia della proteina sondando il legame ferro e zolfo. stati entatici, Bren e Raven sottolineano, sono molto importanti nella chimica bioinorganica:in realtà si traduce in qualcosa che viene allungato quando sottoposto a tensione.
Per comprendere meglio il legame tra i due elementi, i ricercatori li hanno temporaneamente separati usando un laser a elettroni liberi a raggi X con sorgente di luce coerente Linac e poi hanno cronometrato il tempo impiegato dai due componenti per riformarsi usando la spettroscopia di emissione di raggi X del ferro. Hanno scoperto che l'ambiente in cui esistevano aumentava la forza del legame di quattro chilocalorie per mole, che è stato sufficiente per consentire alla proteina di alternare i suoi stati funzionali e per quantificare il costo energetico dello stato entatico.
Come notano Bren e Raven, i risultati dello studio hanno implicazioni per quanto riguarda il ruolo che il citocromo svolge nella respirazione, che si riferiscono alla vita e all'apoptosi, che si riferiscono alla morte. Per promuovere la continuazione della vita, la proteina aiuta a mantenere un certo potenziale di riduzione. Per l'apoptosi, lo stato entatico viene interrotto consentendo l'aumento dell'attività della perossidasi.
© 2017 Phys.org