Un'illustrazione della reazione chimica sviluppata nello studio. Credito:J. Waser/B. Fierz (EPFL)
Comprendere la struttura e il metabolismo delle cellule e degli organismi viventi è essenziale per lo sviluppo di nuovi farmaci e strumenti diagnostici. La disponibilità di strumenti chimici che consentono agli scienziati di modificare le biomolecole, come le proteine, con risoluzione a livello di atomo hanno notevolmente contribuito al progresso della biologia chimica.
Le proteine sono macromolecole costituite da un insieme di venti amminoacidi chimicamente differenti. Un approccio chiave per modificare le proteine è reagire con l'atomo di zolfo nell'aminoacido cisteina. Però, i metodi attuali sono ancora problematici in termini di efficienza, selettività, e stabilità del prodotto finale (l'"addotto").
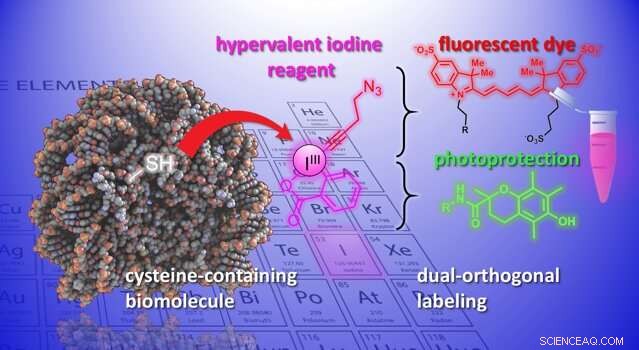
Ora, i laboratori di Jérôme Waser e Beat Fierz presso l'Istituto di scienze chimiche e ingegneria dell'EPFL hanno sviluppato un nuovo metodo per modificare le cisteine su peptidi e proteine. Il metodo utilizza un gruppo di molecole organiche altamente reattive, gli etinilbenziodoxoloni (EBX). Ciò che rende gli EBX altamente reattivi è che contengono un atomo di iodio legato a tre gruppi sostituenti. Questa situazione non naturale porta a un'elevata reattività in questi cosiddetti reagenti "iodio ipervalente".
Per la prima volta, i ricercatori sono stati in grado di generare un semplice addotto biomolecola-EBX mantenendo il loro gruppo di iodio reattivo nella molecola finale. La reazione può essere facilmente eseguita da un non esperto in condizioni fisiologiche standard.
Il prodotto finale sono chimere di reagente di iodio ipervalente proteico che possono fungere da doppi punti di attacco per due nuovi gruppi chimici, aprendo nuove opportunità per lo studio dei processi biologici.
"Una nuova funzionalità può essere introdotta tramite 'click-chimica, ' una reazione ben consolidata nella biologia chimica, " dice Waser. "Usando un catalizzatore al palladio, un'altra modifica selettiva può essere ottenuta all'atomo di iodio reattivo, quella che chiameremmo una funzionalità "bioortogonale", in quanto non esiste in natura." L'introduzione di tali gruppi reattivi esotici nelle biomolecole è attualmente uno degli strumenti più importanti nella biologia chimica, in quanto consente lo studio dei processi biologici senza interferire con essi.
Gli scienziati hanno dimostrato il potenziale del metodo introducendo una serie diversificata di gruppi chimici nelle biomolecole. Per esempio, gli scienziati hanno usato il doppio manico per attaccare simultaneamente un colorante fluorescente e un gruppo fotoprotettivo in un neuropeptide. La loro combinazione migliora la fotostabilità del colorante, e consente l'alta risoluzione, imaging di singole molecole delle interazioni molecolari.
Oltre i peptidi, hanno ulteriormente modificato piccole proteine, e anche grandi complessi proteina-DNA, cosiddetti nucleosomi. Poiché i nucleosomi organizzano il genoma, etichettarli con coloranti fluorescenti può aiutare a rintracciarli per decifrare come la natura regola l'espressione genica.
"Quello che abbiamo sviluppato qui è un nuovo metodo per modificare le proteine basato su studi fondamentali di reattività chimica, " dice Fierz. "L'abbiamo già usato per modificare degli istoni, e ha condotto esperimenti di fluorescenza su cellule viventi. Con questi esempi, abbiamo posto le basi per una migliore comprensione dei processi biologici".
Lo studio è pubblicato su chimica oggi.