
Il cluster HPC "CARL" ha aiutato a decifrare il comportamento della molecola attraverso calcoli approfonditi. Credito:Daniel Schmidt/Università di Oldenburg
In che modo i catalizzatori molecolari, molecole che, come enzimi, può innescare o accelerare determinate reazioni chimiche:funzione, e che effetti hanno? Un team di chimici dell'Università di Oldenburg si è avvicinato alle risposte utilizzando una molecola modello che funziona come una nanobatteria molecolare. È costituito da diversi centri di titanio collegati tra loro da un singolo strato di atomi di carbonio e azoto interconnessi. Il gruppo di ricerca di sette membri ha recentemente pubblicato i suoi risultati, che uniscono i risultati di tre dottorati pluriennali. progetti di ricerca, in ChemPhysChem . La rivista di chimica fisica e fisica chimica presentava in copertina la ricerca di base di Oldenburg.
Per comprendere meglio come funziona la molecola, i ricercatori, guidato dai primi autori Dr. Aleksandra Markovic e Luca Gerhards e autore corrispondente Prof. Dr. Gunther Wittstock, hanno eseguito esperimenti elettrochimici e spettroscopici e hanno utilizzato il cluster di calcolo ad alte prestazioni dell'università per i loro calcoli. Wittstock vede la pubblicazione dell'articolo come una "storia di successo" per entrambi i gruppi di formazione alla ricerca all'interno dei quali il dottorato di ricerca. sono stati condotti progetti e per il cluster di calcolo dell'università. "Senza l'infrastruttura di calcolo ad alte prestazioni, non saremmo stati in grado di eseguire gli estesi calcoli necessari per decifrare il comportamento della molecola, " dice Wittstock. "Ciò sottolinea l'importanza di tali cluster di calcolo per la ricerca attuale".
Nella carta, gli autori presentano i risultati della loro analisi di una struttura molecolare, il cui prototipo è stato il risultato di una reazione chimica inaspettata segnalata per la prima volta dal dipartimento di chimica dell'Università di Oldenburg nel 2006. Si tratta di una struttura molecolare altamente complessa in cui sono collegati tre centri di titanio (comunemente indicati nelle lezioni delle scuole superiori come ioni di titanio) tra loro da un ligando a ponte costituito da carbonio e azoto. Ci si aspetterebbe che un tale composto sia in grado di accettare e rilasciare diversi elettroni attraverso lo scambio di elettroni tra i centri metallici, tra le altre ragioni.
Acquisire una corretta comprensione di questi processi è di particolare interesse non solo per la ricerca di base, ma anche per innescare o accelerare importanti reazioni in cui viene trasferito più di un elettrone. Tali reazioni rimangono una sfida importante nei sistemi tecnici, per i quali non esiste ancora una soluzione soddisfacente. "Molti sforzi sono attualmente concentrati su questo obiettivo, " dice Wittstock. Un esempio è la tecnologia delle celle a combustibile, che richiede il trasferimento simultaneo di quattro elettroni a una molecola di ossigeno per ottenere un flusso di elettroni dall'idrogeno all'ossigeno, lui spiega. "Tali reazioni multielettroniche hanno anche un grande potenziale per il risparmio di materiali o energia nella produzione chimica".
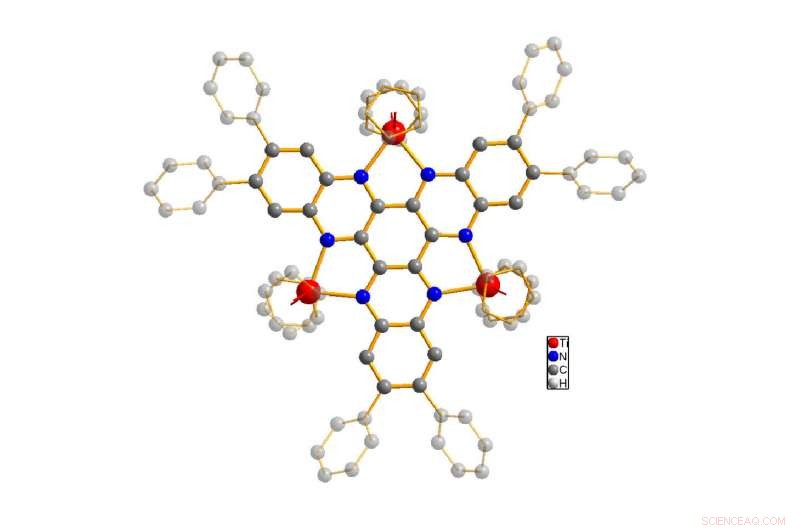
La struttura della molecola in esame (titanio mostrato in rosso, azoto in blu, carbonio in grigio). Il corpo di base della molecola è evidenziato, mentre gli atomi di idrogeno sono nascosti per semplificazione. Credito:Ruediger Beckhaus / Università di Oldenburg
Il composto molecolare modello costituito dal ligando a ponte e dai centri di titanio è stato specificamente progettato per aiutare gli scienziati a ottenere una comprensione dettagliata di come i composti con diversi centri metallici siano in grado di accettare e rilasciare elettroni. Gli scienziati hanno eccitato la molecola con la luce, a cui le molecole hanno risposto in modo diverso a seconda del numero di elettroni accettati e rilasciati. Sfortunatamente, la molecola realizzata nel 2006 si è rivelata poco solubile nella maggior parte dei solventi e quindi difficile da studiare. Utilizzando la sintesi chimica, Dott.ssa Pia Sander, un coautore del documento, ha aggiunto motivi molecolari simili a eliche al composto per migliorarne la solubilità. Questo ha fornito la base per gli esperimenti di Markovic, che ha rivelato che il composto modello potrebbe accettare un totale di tre elettroni o rilasciare sei elettroni, una capacità insolitamente elevata per una singola molecola. In ciascuna di queste reazioni, non solo il colore visibile della molecola cambia, ma l'assorbimento della luce nelle gamme spettrali che sono invisibili all'occhio umano. Inizialmente, però, i cambiamenti precisi nella molecola con diverso numero di elettroni non potevano essere determinati sulla base di quelle gamme spettrali.
È qui che sono entrati in gioco Luca Gerhards e il cluster di calcolo dell'università. Sebbene le spiegazioni comuni si basino sulla premessa che in ogni transizione eccitata dalla luce cambia solo l'energia di un singolo elettrone, il coautore Gerhards ha evitato queste ipotesi semplificatrici nelle sue equazioni chimiche quantistiche. Ciò ha reso i calcoli ancora più complessi e ha tenuto occupato per mesi il cluster di elaborazione ad alte prestazioni. Alla fine, il risultato è stato una sorpresa per tutti i soggetti coinvolti:diversi elettroni cambiano i loro livelli di energia contemporaneamente quando la luce colpisce la molecola oggetto di studio. Inoltre, questa carica non è immagazzinata nel titanio, come ci si aspetterebbe, ma principalmente nel ligando a ponte, il 'collegamento' tra i centri di titanio.
Come spiega Wittstock, i centri metallici forniscono quindi un "frame" caricato positivamente per l'immagazzinamento di elettroni, come in una "nanobatteria". La molecola modello - e per estensione un'intera classe di composti simili - si è rivelata un "mini segmento di un materiale di accumulo di energia". Sebbene il loro pieno potenziale non possa essere determinato in questa fase, Wittstock ritiene che tali "frame" con motivi di accumulo di carica molecolare potrebbero diventare un nuovo elemento di progettazione in catalizzatori molecolari complessi per reazioni multielettroniche.