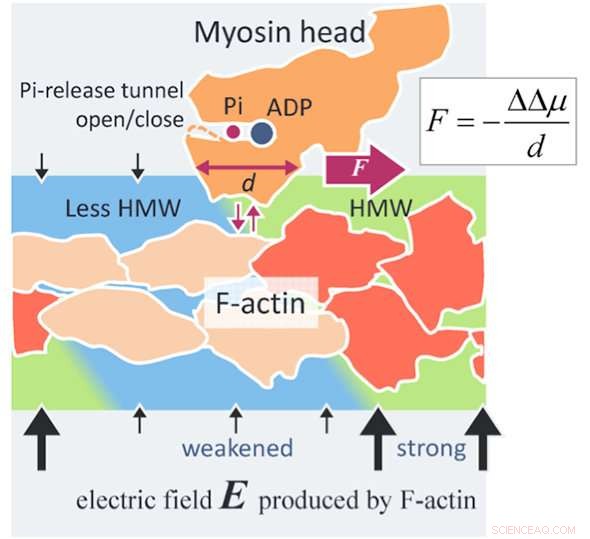
Un nuovo meccanismo di generazione della forza dell'actomiosina. Un filamento di actina (F-actina) produce un campo elettrico (frecce nere) fino a 100 MV/m attorno all'F-actina a causa delle sue cariche superficiali negative. Le molecole d'acqua in un campo elettrico così elevato diventano molecole d'acqua ipermobili (HMW, verde chiaro) in prossimità di F-actina. D'altra parte, L'ATP in soluzione si lega a una testa di miosina (arancione) ed è scissa in adenosina difosfato (ADP) e fosfato inorganico (Pi) nella testa. Quando la testa della miosina con ADP e Pi si lega con F-actina (rosso arancio), diverse subunità di actina cambiano le loro strutture (beige). Quindi l'intensità del campo elettrico diminuisce attorno a queste subunità di actina modificate e anche l'intensità HMW diminuisce (azzurro) per avvicinarsi all'acqua libera. In questo studio, lo stato di idratazione delle proteine è risultato essere più stabile nella regione HMW più forte. Nella figura, la testa della miosina è spinta a destra dove l'intensità HMW è più forte (verde chiaro), con distacco da F-actina e attaccamento di nuovo con F-actina. La forza valutata con il presente metodo è pari a diversi piconewton, che è al livello dei valori sperimentali. Questo può essere un principio di una nuova forza superficiale che agisce tra una macromolecola carica, come proteine e DNA, e una proteina soluta ampiamente applicabile alla scienza e alla tecnologia. Credito:Makoto Suzuki
Il complesso actina e miosina (actomiosina) genera la forza di contrazione di un muscolo utilizzando la reazione di idrolisi dell'adenosina trifosfato (ATP). Sono stati quindi fatti molti tentativi per spiegare l'origine molecolare della motilità dell'actomiosina.
Un modello di colpo di potenza della miosina, proposto da Huxley e Simmons nel 1971, ha avviato molte ricerche, inclusi studi sulla struttura atomica e l'indagine sulla biologia molecolare delle molecole di miosina e actina. Il modello della corsa di potenza, modificato di recente, è ampiamente adottato nei libri di testo di biologia standard.
Però, rimane un problema serio. Secondo i dati di termodinamica sperimentale, l'idrolisi dell'ATP nella testa della miosina non produce uno stato di miosina con un'energia sufficientemente elevata per generare la forza di contrazione.
Ora, un gruppo di ricerca, guidato dal Professore Emerito Makoto Suzuki presso la Tohoku University in collaborazione con il Professor Nobuyuki Matubayasi presso l'Università di Osaka, è riuscito a spiegare il meccanismo di guida dell'actomiosina secondo i dati sperimentali della termodinamica.
Nello studio, la struttura dell'acqua in prossimità di un filamento di actina (F-actina) viene modificata dal legame con una testa di miosina che idrolizza l'ATP in F-actina, che porta ad un cambiamento nell'affinità alla testa della miosina e quindi alla generazione della forza motrice dell'actomiosina.
La presenza della nuova forza superficiale intermolecolare - che è stata dimostrata per la prima volta sulla base delle attuali analisi di idratazione - è stata una scoperta notevole. Questo articolo è, perciò, il primo a svelare con successo il meccanismo di guida dell'actomiosina introducendo una nuova forza superficiale intermolecolare.