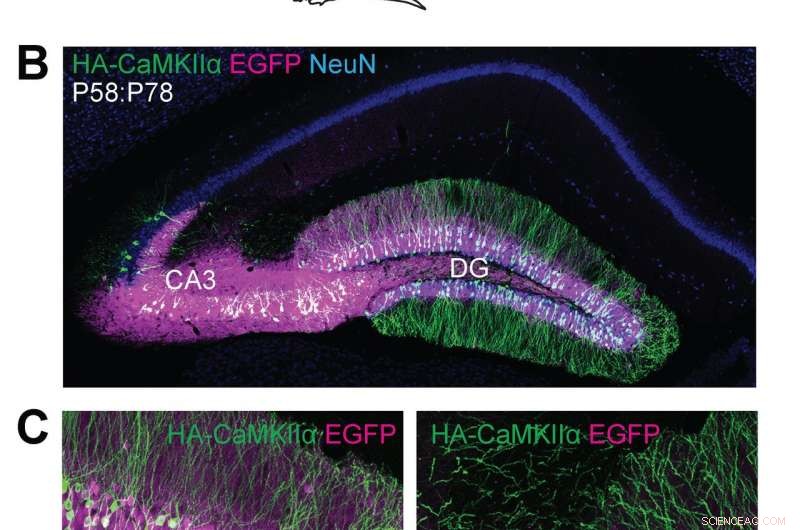
(A) illustrazioni schematiche di esperimenti. (B, C) Immagini microscopiche confocali di sezioni cerebrali coronali dell'ippocampo di topi Cas9, mostrando la fluorescenza EGFP (B, C, magenta), immunoreattività per NeuN (B, blu) e il tag HA (B, C, verde) fuso all'N-terminale di CaMKIIα endogeno. Credito:Max Planck Florida Institute for Neuroscience
Le tecnologie di modifica del genoma hanno rivoluzionato la scienza biomedica, fornendo un modo semplice e veloce per modificare i geni. Però, la tecnica che consente agli scienziati di eseguire le modifiche più precise, non funziona nelle cellule che non si dividono più, il che include la maggior parte dei neuroni nel cervello. Questa tecnologia aveva un uso limitato nella ricerca sul cervello, fino ad ora. Ricercatore Jun Nishiyama, M.D., dottorato di ricerca, Ricercatore, Takayasu Mikuni, M.D., dottorato di ricerca, e Direttore Scientifico, Ryohei Yasuda, dottorato di ricerca presso il Max Planck Florida Institute for Neuroscience (MPFI) hanno sviluppato un nuovo strumento che, per la prima volta, consente l'editing preciso del genoma nei neuroni maturi, aprendo vaste nuove possibilità nella ricerca neuroscientifica.
Questo nuovo e potente strumento utilizza la tecnologia di editing genetico recentemente scoperta di CRISPR-Cas9, un meccanismo di difesa virale originariamente trovato nei batteri. Quando collocato all'interno di una cellula come un neurone, il sistema CRISPR-Cas9 agisce per danneggiare il DNA in un luogo specificamente mirato. La cellula quindi successivamente ripara questo danno utilizzando principalmente due metodi opposti; uno è l'unione di estremità non omologhe (NHEJ), che tende a essere soggetto a errori, e riparazione diretta per omologia (HDR), che è molto preciso e in grado di subire inserzioni geniche specificate. L'HDR è il metodo più desiderato, consentendo ai ricercatori la flessibilità di aggiungere, modificare, o eliminare i geni a seconda dello scopo previsto.
Convincere le cellule del cervello a utilizzare in modo preferenziale il meccanismo di riparazione del DNA HDR è stato piuttosto impegnativo. Inizialmente si pensava che l'HDR fosse disponibile solo come via di riparazione per le cellule attivamente proliferanti nel corpo. Quando le cellule cerebrali precursori maturano in neuroni, sono indicate come cellule post-mitotiche o non in divisione, rendendo il cervello maturo in gran parte inaccessibile all'HDR, o almeno così pensavano i ricercatori. Il team ha ora dimostrato che è possibile che i neuroni post-mitotici del cervello subiscano attivamente l'HDR, definendo la strategia "vSLENDR (etichettatura di singole cellule virali mediate da proteine endogene mediante riparazione diretta dall'omologia mediata da CRISPR-Cas9)." La chiave fondamentale per il successo di questo processo è l'uso combinato di CRISPR-Cas9 e di un virus.
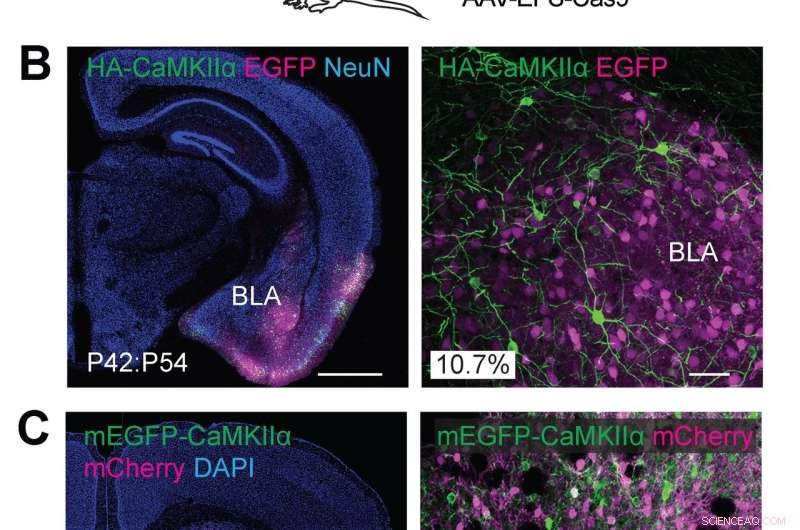
(A) illustrazioni schematiche di esperimenti. (B) Immagini microscopiche confocali di sezioni cerebrali coronali dell'amigdala di topi wild type, mostrando la fluorescenza EGFP (B, magenta), immunoreattività per NeuN (a sinistra) e il tag HA (verde) fusi all'N-terminale di CaMKIIα endogeno. (C) Immagini microscopiche confocali di sezioni cerebrali coronali dello striato di topi wild type, che mostra il segnale DAPI (a sinistra), la fluorescenza mCherry (magenta), la fluorescenza mEGFP (verde) fusa all'N-terminale di CaMKIIα endogeno. Credito:Max Planck Florida Institute for Neuroscience
Il virus adeno-associato (AAV) è un virus a bassa immunogenicità, virus non tossico utilizzato dagli scienziati come meccanismo di somministrazione efficiente per tutti i tipi di geni. Questo virus può fornire efficacemente il modello di donatore necessario per HDR, aumentandone l'efficienza. Il team ha prima confezionato il macchinario necessario per l'editing del genoma nell'AAV e lo ha consegnato ai neuroni di topi transgenici che esprimono Cas9, ottenere un HDR straordinariamente efficiente nei neuroni post-mitotici del cervello.
Successivamente hanno creato un sistema a doppio virus che consente loro di utilizzare la tecnologia in animali che non erano stati progettati per esprimere Cas9. Hanno testato questo sistema a doppio virus in un modello murino di Alzheimer invecchiato, dimostrando che la tecnica vSLENDR può essere applicabile in modelli patologici anche in età avanzata.
vSLENDR è un nuovo potente strumento sia per le scienze di base che per quelle traslazionali, in grado di modificare con precisione le informazioni genetiche indipendentemente dal tipo di cellula, maturità cellulare, regione del cervello, o età. Il nuovo vSLENDR è più efficiente, flessibile, e conciso, consentendo ai ricercatori di studiare una miriade di processi e funzionalità cerebrali con una facilità senza precedenti. Altrettanto importante è il suo potenziale utilizzo in modelli di malattie neuropatologiche, accelerare la ricerca e lo sviluppo di nuove terapie; stabilire la scienza di base di oggi come base per le cure di domani.
Lo studio è pubblicato su Neurone .