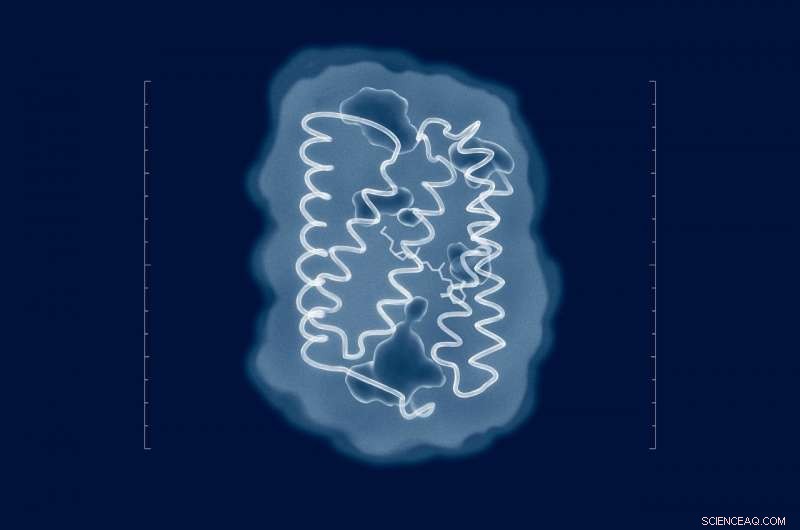
I tentativi di risolvere la struttura di ChR2 risalgono al momento della sua scoperta nel 2003. Ma nonostante gli sforzi di numerosi gruppi di ricerca di tutto il mondo, la struttura della proteina nel suo stato naturale è rimasta sconosciuta. Ora che i ricercatori hanno la struttura, mutazioni significative possono essere introdotte nella proteina per adattare le sue proprietà ai requisiti di uno specifico esperimento. Credito:MIPT
Un team internazionale di ricercatori ha determinato la struttura 3-D della channelrhodopsin 2, una proteina di membrana ampiamente utilizzata in optogenetica per controllare le cellule nervose con la luce. L'optogenetica è una tecnica relativamente nuova che prevede l'uso della luce per manipolare le cellule nervose e muscolari in un organismo vivente. Approcci simili vengono utilizzati per invertire parzialmente la perdita dell'udito e della vista e controllare le contrazioni muscolari.
Inoltre, i metodi dell'optogenetica sono utilizzati per studiare le proprietà delle reti neuronali naturali, responsabili delle emozioni, il processo decisionale, e altri processi complessi negli organismi viventi. L'optogenetica era Natura 's "Metodo dell'anno 2010, " oltre ad essere nominato tra Scienza 's "Breakthroughs of 2010 and Insights of the Decade".
Canalerodopsina 2, o ChR2, è un importante strumento optogenetico. È una proteina sensibile alla luce che è stata originariamente estratta nel 2003 da un'alga verde chiamata Chlamydomonas reinhardtii. Gli scienziati possono inserire ChR2 nella membrana di una cellula vivente per controllarlo. Quando è illuminato, questa proteina consente agli ioni caricati positivamente di passare nella cellula attraverso la membrana cellulare. In una cellula nervosa, questo depolarizza la membrana, imitando l'effetto di un impulso nervoso e provocando l'attivazione di questo particolare neurone.
Poiché ChR2 funziona velocemente ed è relativamente innocuo per le cellule, è l'attuale soluzione ideale per l'attivazione delle cellule nervose. È disponibile una gamma di mutazioni indotte artificialmente per alterare le proprietà della proteina. Per esempio, è possibile aumentare la corrente che genera o alterare la lunghezza d'onda della luce a cui risponde. Tali modifiche consentono agli sperimentatori di lavorare con proteine su misura per le loro esigenze. I ricercatori possono persino combinare diverse varianti proteiche per una risposta distinta a varie lunghezze d'onda della luce.
La maggior parte delle mutazioni utilizzate per modificare le proprietà di ChR2 sono state finora introdotte più o meno a caso, tramite evoluzione diretta o sulla base dei dati sulle strutture proteiche note. I ricercatori più vicini mai a una struttura ChR2 realistica è una strana combinazione chiamata C1C2, Il 70% del quale è basato su ChR1, una proteina correlata, con il resto basato sull'effettivo ChR2. Questa struttura mista non può spiegare tutte le proprietà della proteina. Di conseguenza, le mutazioni previste da questo modello non sono del tutto realistiche e quindi sono di limitato interesse per l'optogenetica.
Per rivelare la struttura di ChR2, gli autori dello studio hanno utilizzato una tecnica analitica chiamata diffrazione dei raggi X, che funziona solo con campioni sotto forma di cristallo. Questi sono stati ottenuti dai ricercatori tramite meso cristallizzazione. Vale a dire, i cristalli proteici sono stati coltivati nella cosiddetta mesofase lipidica cubica, un mezzo che consente alle proteine di muoversi liberamente senza lasciare la membrana. Per determinare le strutture proteiche, i loro cristalli sono stati irradiati con raggi X a una lunghezza d'onda di circa 1 angstrom, che è leggermente inferiore alla lunghezza dei legami tra gli atomi nella proteina. Nella cristallografia a raggi X, le strutture sono derivate analizzando come la radiazione viene diffusa da un campione.
"I tentativi di risolvere la struttura di ChR2 risalgono al momento della sua scoperta nel 2003. Ma nonostante gli sforzi di numerosi gruppi di ricerca di tutto il mondo, la struttura della proteina nel suo stato naturale è rimasta sconosciuta, "dice Valentin Borshchevskiy, uno degli autori dell'articolo e vice capo del Laboratory for Advanced Studies of Membrane Proteins al MIPT. "Ora che abbiamo la struttura, mutazioni significative possono essere introdotte nella proteina per adattare le sue proprietà ai requisiti di uno specifico esperimento. Non conoscendo la struttura, abbiamo dovuto elaborare noiosamente le mutazioni utili per tentativi ed errori o accontentarci dei dati sulle proteine correlate".