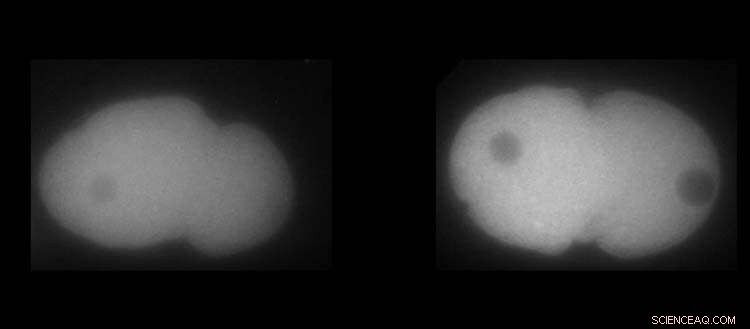
A sinistra, proteina MEX-5. A destra, la proteina PLK-1 negli embrioni di C. elegans. Il bianco mostra la presenza maggiore o minore delle proteine. Credito:UNIGE / Laboratoire Monica Gotta
Ciascuna delle nostre cellule contiene circa 40 milioni di proteine che insieme svolgono tutti i compiti di cui la cellula ha bisogno per sopravvivere. Per un'azione regolare, le proteine giuste devono essere concentrate in quantità specifiche, in un momento specifico e in un luogo specifico. Tuttavia, stabilire una distribuzione così delicata richiede un processo estremamente preciso, che si verifica a minuscole risoluzioni spaziali che gli strumenti di biologia cellulare standard spesso non sono in grado di rilevare. Per capire come funziona questo meccanismo, i ricercatori dell'Università di Ginevra (UNIGE) hanno sviluppato un nuovo approccio che combina esperimenti di genetica e biologia cellulare con modelli fisici. Utilizzando algoritmi specifici, hanno simulato la formazione di gradienti proteici in 3D e nel tempo e sono stati in grado di spiegare questi complessi meccanismi. Inoltre, il loro modello innovativo può essere adattato ad altri sistemi biologici per studiare la dinamica delle proteine. Questi risultati possono essere letti negli Atti dell'Accademia Nazionale delle Scienze .
Come una goccia di inchiostro in un bicchiere d'acqua, le proteine possono diffondersi e distribuirsi uniformemente in tutta la cellula. Tuttavia, per alcuni compiti, le proteine devono formare gradienti. "I gradienti proteici, che derivano dalla distribuzione non uniforme delle proteine in specifiche aree cellulari, sono centrali per molte funzioni cellulari e dell'organismo", spiega Monica Gotta, professoressa nel Dipartimento di Fisiologia e Metabolismo Cellulare e nel Centro di Ricerca Traslazionale di Onco- ematologia (CRTOH) presso la Facoltà di Medicina dell'UNIGE, che ha diretto questo lavoro. "Ad esempio, i gradienti proteici sono importanti per la differenziazione cellulare, il processo mediante il quale i diversi tipi cellulari che costituiscono un organismo complesso emergono da una cellula unica, l'uovo fecondato".
Un uso della casualità
La proteina PLK-1, un regolatore chiave della divisione cellulare, è nota per essere più concentrata nella parte anteriore dell'embrione. Ma come si può mettere in atto questo meccanismo e quali sarebbero le conseguenze se il più piccolo dettaglio andasse storto? Poiché i soliti strumenti della biologia non erano sufficienti per rispondere a questa domanda, Monica Gotta è stata felice di accogliere nel suo team una fisica, Sofia Barbieri, ricercatrice post-dottorato presso il Dipartimento di Fisiologia e Metabolismo Cellulare presso la Facoltà di Medicina dell'UNIGE.
"Compiendo tutto ciò che si conosce su questo processo biologico e nuove ipotesi sui meccanismi, ho sviluppato un modello statistico di formazione del gradiente proteico basato sulla matematica probabilistica", spiega Sofia Barbieri. "Ho fatto ricorso a specifici algoritmi di calcolo, chiamati simulazioni Monte Carlo, dal nome della famosa città del gioco d'azzardo". Questi algoritmi vengono utilizzati per modellare fenomeni con un elevato livello di complessità, come la finanza, il trading o la fisica delle particelle.
Il team è stato in grado di simulare i gradienti proteici, non solo in 3D, ma anche nel tempo. Un tale modello richiedeva tuttavia diverse iterazioni tra l'ottimizzazione dei parametri e il confronto con i dati biologici. I ricercatori hanno costruito una prima versione del modello incorporando tutti gli elementi fisici e biologici conosciuti del sistema, quindi hanno introdotto parametri specifici necessari per testare diverse ipotesi riguardanti le variabili sconosciute. Hanno simulato possibili risultati fisici e biologici che riproducevano computazionalmente la dinamica delle proteine e l'instaurazione del gradiente nella cellula e li hanno testati nella vita reale con esperimenti in vivo usando gli embrioni di un piccolo verme, il nematode C. elegans.
Interazioni proteiche complesse in gioco
Grazie alla continua interazione tra modellazione e biologia cellulare, i ricercatori UNIGE sono stati in grado di determinare come il gradiente PLK-1 è stato stabilito e mantenuto nel tempo. Infatti, PLK-1 deve legarsi e sciogliersi dinamicamente da MEX-5, un'altra proteina cruciale per lo sviluppo nell'embrione di C. elegans, per contrastare la sua naturale tendenza a diffondersi in modo omogeneo nella cellula. MEX-5 ha infatti la capacità di cambiare la sua diffusività a seconda della sua posizione all'interno della cellula e di interagire con altre proteine, essenziale per arricchire PLK-1 dove necessario. "Ma abbastanza sorprendentemente, MEX-5 non è così efficiente nel suo compito, poiché una grande quantità di PLK-1 non è vincolata a MEX-5", sottolinea Sofia Barbieri.
Questo studio fornisce un modello quantitativo unico per comprendere le interazioni dinamiche tra proteine e può essere adattato ad altre cellule o proteine per le quali i complessi meccanismi non possono essere testati con i normali esperimenti di biologia cellulare. "Il nostro lavoro mostra che le collaborazioni interdisciplinari sono sempre più importanti per avanzare nella ricerca", conclude Monica Gotta.