Credito:Angewandte Chemie (2022). DOI:10.1002/ange.202117849
La β-N-acetilglucosamina legata all'O (O-GlcNAcylation), un'importante modifica post-traduzionale (PTM) delle proteine, è coinvolta in varie funzioni biologiche.
La modifica reversibile di O-GlcNAc conferisce funzioni proteiche on-off durante i processi biologici. Le aberrazioni dell'O-GlcNAcilazione sono strettamente associate a molte malattie metaboliche insieme all'invasione e alla metastasi di diversi tumori.
Recentemente, un gruppo di ricerca guidato dal Prof. Ye Mingliang e dal Prof. Qin Hongqiang del Dalian Institute of Chemical Physics (DICP) dell'Accademia cinese delle scienze (CAS), in collaborazione con il Prof. Huang Wei dello Shanghai Institute of Materia Medica di CAS, ha sviluppato una nuova strategia di etichettatura chemioenzimatica reversibile dei glicopeptidi O-GlcNAc, che ha consentito un'analisi approfondita della proteina O-GlcNAcilazione.
I loro risultati sono stati pubblicati su Angewandte Chemie il 14 marzo.
Per consentire l'analisi dell'intero proteoma dell'O-GlcNAcilazione, è essenziale arricchire selettivamente i glicopeptidi dal digerito di campioni complessi.
Molti ricercatori hanno cercato l'arricchimento dei peptidi O-GlcNAcilati prima dell'analisi mediante cromatografia liquida con spettrometria di massa tandem (LC-MS/MS). Tuttavia, la maggior parte degli approcci soffre di debole affinità di legame o tag voluminosi, che interferiscono con l'arricchimento e l'identificazione dei peptidi O-GlcNAcilati.
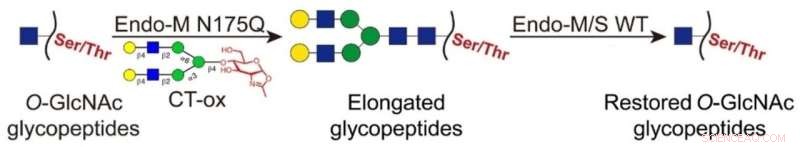
In questa strategia di nuova concezione, le frazioni O-GlcNAc sono state legate con lunghi N-glicani utilizzando un mutante Endo-M, che ha consentito l'arricchimento dei glicopeptidi marcati mediante cromatografia liquida a interazione idrofila (HILIC). Quindi, i glicani attaccati sui glicopeptidi arricchiti sono stati rimossi mediante Endo-M/S di tipo selvaggio per ripristinare la parte O-GlcNAc.
Rispetto alla classica etichettatura chemioenzimatica, questo approccio ha consentito l'identificazione senza tag ed ha eliminato l'interferenza di tag voluminosi nel rilevamento dei glicopeptidi.
Inoltre, utilizzando questo metodo, i ricercatori hanno identificato 657 potenziali glicositi O-GlcNAc da soli 0,4 mg di proteine nucleari delle cellule HeLa, di cui era necessario solo 1/10 di campioni proteici per un'analisi comparabile di O-GlcNAcilazione, indicando l'elevata sensibilità di questo metodo.
In totale, hanno identificato 1.414 glicositi da soli 1,1 mg di campioni proteici e il 45% di essi non è stato incluso in O-GlcNAcAltas di tutti i campioni umani negli ultimi 35 anni, il che ha migliorato la copertura dell'analisi della proteina O-GlcNAcilazione.
"Questa strategia di arricchimento senza tag rappresenta una strada unica per l'analisi a livello di proteoma dell'O-GlcNAcilazione e promuove gli studi sui meccanismi", ha affermato il prof. Ye. + Esplora ulteriormente