
I ricercatori hanno prodotto immagini colorate su piastre di coltura utilizzando rosso, verde, e luci blu per controllare il pigmento prodotto dai batteri con “visione multicolore”. L'immagine è stata corretta per il colore in Photoshop per migliorare il contrasto. Credito:Felix Moser
I ricercatori del MIT hanno ingegnerizzato batteri con "visione multicolore"—E. coli che riconoscono il rosso, verde, o luce blu (RGB) e, in risposta ad ogni colore, esprimono geni diversi che svolgono diverse funzioni biologiche.
Per mostrare la tecnologia, i ricercatori hanno prodotto diverse immagini colorate su piastre di coltura, una delle quali indica "MIT", utilizzando luci RGB per controllare il pigmento prodotto dai batteri. Fuori dal laboratorio, la tecnologia potrebbe rivelarsi utile anche per scopi commerciali, farmaceutico, e altre applicazioni.
L'E. coli è programmato con un sistema a base di proteine ed enzimi, analogo a un chip di computer, con diversi moduli diversi per elaborare l'input luminoso e produrre un output biologico. In termini informatici, un "array di sensori" si attiva prima in presenza di rosso, verde, o luce blu, e un "circuito" elabora il segnale. Quindi, un "ripartitore di risorse" collega le informazioni elaborate ad "attuatori" che attuano la corrispondente funzione biologica.
Pensa al nuovo E. coli come a marionette microbiche, con luce colorata invece di fili di burattini che fanno agire i batteri in un certo modo, dice il professore di ingegneria biologica del MIT Chris Voigt, coautore di un articolo su Nature che descrive la tecnologia. "Utilizzando colori diversi, possiamo controllare diversi geni che vengono espressi, " lui dice.
I coautori del documento sono gli ex postdoc Jesus Fernandez-Rodriguez, Felix Moser, e Miryoung Song.
L'innovazione della biologia sintetica si unisce
Nel 2005, Voigt, che co-dirige il Centro di Biologia Sintetica al MIT, e altri ricercatori hanno aperto la strada a una "fotocamera batterica" programmando un sensore di luce in un ceppo di E. coli, insieme a un gene che ha prodotto il pigmento nero. Quando la luce brillava attraverso uno stencil su un piatto ricoperto di batteri, i microbi hanno formato immagini in bianco e nero. Al tempo, questa impresa ha richiesto solo quattro geni e tre promotori, regioni del DNA che avviano la trascrizione genica, per portare a termine il lavoro.
Nuovi strumenti di biologia sintetica, come il sistema di modifica del genoma CRISPR, sono spuntati da allora, aprendo più ampie possibilità ai ricercatori. A differenza del sistema del 2005, il nuovo sistema RGB, il primo a utilizzare tre colori, è composto da 18 geni e 14 promotori, tra le altre parti, così come 46, 000 paia di basi di DNA.
Ma con una maggiore complessità arrivano maggiori sfide. Poiché i ricercatori avevano a che fare con un array di sensori in grado di rilevare tre colori separati, ad esempio, dovevano includere nel programma microbico una proteina che impedisse la trascrizione genica dei due sensori inutilizzati.
In termini informatici, questo è chiamato un "NOT gate, " un circuito che produce un segnale di uscita, in questo caso, repressione genica, solo quando non c'è un segnale sul suo input. Con i batteri sotto una luce rossa, ad esempio, la porta NOT libererebbe quella proteina che reprime il gene sui sensori verde e blu, spegnendoli.
Circa cinque anni fa, Voigt ha guidato un team che ha progettato i microbi per rispondere alla luce rossa e verde. L'aggiunta di un terzo sensore è stata una delle principali sfide della nuova ricerca. "Dentro la cella, tutti i nuovi sensori proteici aggiunti interferiscono tra loro, perché sono tutte molecole che urtano intorno alla cellula, e tutti richiedono di mantenere viva e felice la cellula. Con ogni sensore aggiuntivo che aggiungi, che diventa esponenzialmente più difficile, " lui dice.
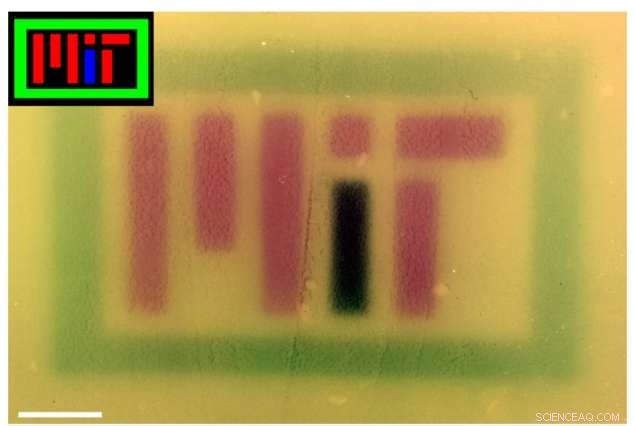
Le immagini colorate (riquadri) sono state proiettate su piastre di batteri contenenti il sistema RGB per scrivere "MIT". L'immagine è stata corretta per il colore in Photoshop per migliorare il contrasto. Credito:Felix Moser
A tal proposito, Voigt aggiunge, allocatore di risorse del sistema, una nuova funzionalità, funge anche da interruttore automatico, spegnendo i sensori se tutti e tre si accendono contemporaneamente, sovraccaricare la cellula.
Dal punto di vista dell'ingegneria genetica, la configurazione a quattro sottosistemi è stata "il più grande impatto di questo lavoro, " Dice Voigt. Ogni sottosistema, la serie di sensori, circuiti, attuatori di risorse, e attuatori—è stato progettato, costruito, e ottimizzato in isolamento prima di essere assemblato in una struttura finale. Questo semplificato, processo modulare potrebbe aprire la strada a una programmazione biologica più complessa in futuro, secondo i ricercatori.
Parlando in generale, Voigt vede il nuovo sistema come il culmine di un decennio di innovazioni di biologia sintetica. "È una rappresentazione di dove siamo attualmente, e tutti i pezzi che hanno dovuto unirsi nell'ultimo decennio per creare sistemi di questa scala e complessità, " lui dice.
Fare "batteri da discoteca"
Per realizzare le nuove immagini a colori, i ricercatori hanno programmato i batteri per produrre lo stesso pigmento del rosso, verde, o la luce blu brillava su di loro. In un incubatore, i ricercatori hanno rivestito una capsula di Petri con batteri geneticamente identici. "Puoi pensarlo come un film non sviluppato, dove hai la capsula di Petri con sopra dei batteri, "Vogt dice, "e la macchina fotografica è l'incubatrice."
Nella parte superiore dell'incubatrice c'è un buco, dove un'immagine stampata viene proiettata sulla lastra. Col tempo, i batteri crescono, producendo un enzima che produce un pigmento corrispondente al colore RBG da cui sono illuminati. Oltre al logo del MIT, i ricercatori hanno prodotto immagini di vari modelli, frutta multicolore, e il personaggio dei videogiochi Super Mario.
I batteri ingegnerizzati potrebbero anche essere utilizzati per avviare e arrestare rapidamente le reazioni chimiche dei microbi nei processi di fermentazione industriale, che vengono utilizzati per produrre prodotti farmaceutici e altri prodotti. Oggi, il controllo di tali reazioni chimiche richiede lo scarico di diversi additivi chimici in grandi tini di fermentazione, che richiede tempo ed è inefficiente.
Nella loro carta, i ricercatori hanno dimostrato questo concetto di "sostanze chimiche su richiesta" su piccola scala. Utilizzando gli strumenti di modifica genetica CRISPR, hanno modificato tre geni che producono acetato, un sottoprodotto a volte indesiderato di vari bioprocessi, per produrre meno sostanza chimica in risposta alle luci RGB.
"Individualmente, e in combinazione tra loro, i diversi colori della luce riducono la produzione di acetato senza sacrificare l'accumulo di biomassa, " hanno scritto i ricercatori nel loro articolo.
Voigt ha coniato un nome divertente per questi microbi industriali. "Mi riferisco a loro come 'batteri da discoteca, '" lui dice, "perché luci di colore diverso lampeggiano all'interno del fermentatore e controllano le cellule".
Una futura applicazione, Voigt aggiunge, potrebbe essere nel controllo delle cellule per formare vari materiali e strutture. Ricercatori, compresi alcuni al MIT, hanno iniziato a programmare celle da assemblare in materiali viventi che un giorno potrebbero essere utilizzati per progettare celle solari, materiali di autoguarigione, o sensori diagnostici.
"È incredibile quando guardi il mondo e vedi tutti i diversi materiali, " dice Voigt. "Cose come la cellulosa, proteine della seta, metalli, nanofili, e materiali viventi come gli organi, tutte queste diverse cose in natura che otteniamo dalle cellule che crescono secondo schemi diversi. Puoi immaginare di usare diversi colori di luce per dire alle cellule come dovrebbero crescere come parte della costruzione di quel materiale".
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.