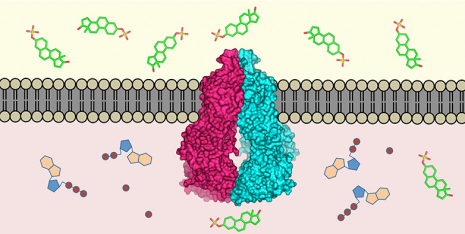
La proteina di trasporto ABCG2 (al centro) è incorporata nella membrana cellulare. Riconosce oltre 200 sostanze all'interno della cellula (sotto) e le trasporta all'esterno (sopra). Credito:ETH Zurigo / Scott Jackson, Ioannis Manolardis, Kaspar Locher
Le proteine di trasporto nelle cellule del nostro corpo ci proteggono da particolari tossine. I ricercatori dell'ETH di Zurigo e dell'Università di Basilea hanno ora determinato la struttura tridimensionale ad alta risoluzione di una delle principali proteine di trasporto umano. A lungo termine, questo potrebbe aiutare a sviluppare nuovi farmaci.
Quasi tutte le creature viventi hanno evoluto meccanismi per rimuovere le tossine che sono entrate nelle loro cellule:le pompe molecolari situate nella membrana cellulare riconoscono le sostanze nocive all'interno della cellula e le trasportano all'esterno. I ricercatori dell'ETH di Zurigo e del Biozentrum dell'Università di Basilea hanno ora definito la struttura tridimensionale di una tale proteina di trasporto nell'uomo (la proteina ABCG2) a livello atomico. Questa è la prima volta che una struttura del genere è stata definita per un trasportatore multidroga umano. Gli scienziati hanno pubblicato il loro lavoro nell'ultimo numero della rivista scientifica Natura .
"La proteina ABCG2 riconosce e trasporta almeno 200 sostanze note, " spiega Kaspar Locher, Professore di biologia delle membrane molecolari all'ETH di Zurigo e capo dello studio. Queste sostanze includono alcaloidi – sostanze vegetali che ingeriamo con il nostro cibo – ma anche sostanze prodotte dall'organismo stesso, come l'acido urico o la bilirubina (un metabolita dell'emoglobina).
La proteina è attiva nella parete intestinale, Per esempio, dove impedisce alle sostanze nocive di entrare nel sangue; si trova anche nelle cellule della barriera ematoencefalica, dove tiene le tossine lontane dal cervello. Le proteine come ABCG2 svolgono anche un ruolo importante nelle ghiandole mammarie e nella placenta, dove assicurano che le tossine non entrino nel latte materno o nel flusso sanguigno di un nascituro.
Spada a doppio taglio
Il ruolo dei trasportatori multidroga ha un rovescio della medaglia, tuttavia:le proteine pompano anche alcuni farmaci fuori dalle cellule, impedendo loro di agire in quelle cellule. "Ciò significa che quando si sviluppano farmaci, è sempre importante indagare se sono riconosciuti da proteine di trasporto come ABCG2, " dice Locher. I farmaci somministrati per via orale devono penetrare nella parete intestinale, e quelli destinati al cervello devono superare la barriera emato-encefalica, cosa che possono fare solo se ABCG2 non li riconosce.
È risaputo, però, che ABCG2 riconosce alcuni farmaci antitumorali (chemioterapici). Ciò è particolarmente grave perché alcune cellule tumorali sono in grado di aumentare il numero di proteine ABCG2 nelle loro membrane cellulari. Tali cellule pompano efficacemente la sostanza chemioterapica verso l'esterno, il che significa che sono resistenti al farmaco.
Sviluppare farmaci con i computer
Ora che gli scienziati conoscono la struttura di ABCG2, in futuro potrebbero essere in grado di simulare su un computer se nuovi farmaci saranno riconosciuti dalla proteina di trasporto. I ricercatori potrebbero anche utilizzare la modellizzazione al computer per sviluppare anticorpi migliori per la diagnosi di cellule tumorali resistenti ai farmaci, o farmaci che inibiscono la proteina di trasporto. Tali sostanze potrebbero aiutare a superare le resistenze a particolari chemioterapici. "I contributi della nostra ricerca alla medicina, in particolare medicina del cancro, dovrebbe davvero essere visto a lungo termine. Stiamo principalmente costruendo le basi, " sottolinea Locher.
ABCG2 è una molecola molto mobile, che ha reso difficile determinare la sua struttura atomica. Utilizzando anticorpi stabilizzanti, però, gli scienziati sono riusciti a immobilizzare la proteina. La struttura tridimensionale è stata determinata utilizzando la microscopia crioelettronica dai ricercatori dell'ETH in collaborazione con Henning Stahlberg, professore al Biozentrum dell'Università di Basilea, e il suo gruppo. "Di recente abbiamo lavorato intensamente per ottimizzare la capacità di risoluzione dei nostri microscopi elettronici, e automatizzandoli sostanzialmente allo stesso tempo. Ciò ha ora portato a una pipeline di determinazione della struttura incredibilmente veloce, "dice Stahlberg.
La microscopia crioelettronica è una tecnologia relativamente nuova per la determinazione delle strutture molecolari atomiche. "Questa tecnologia ha innescato una rivoluzione nella biologia strutturale, " dice Locher. Vista la sua importanza, L'ETH di Zurigo continuerà a investire nel metodo e acquisirà un secondo microscopio crioelettronico di fascia alta per il centro di microscopia ScopeM. Sarà a disposizione di tutti i ricercatori delle scienze della vita per studiare molecole e strutture con risoluzione atomica.