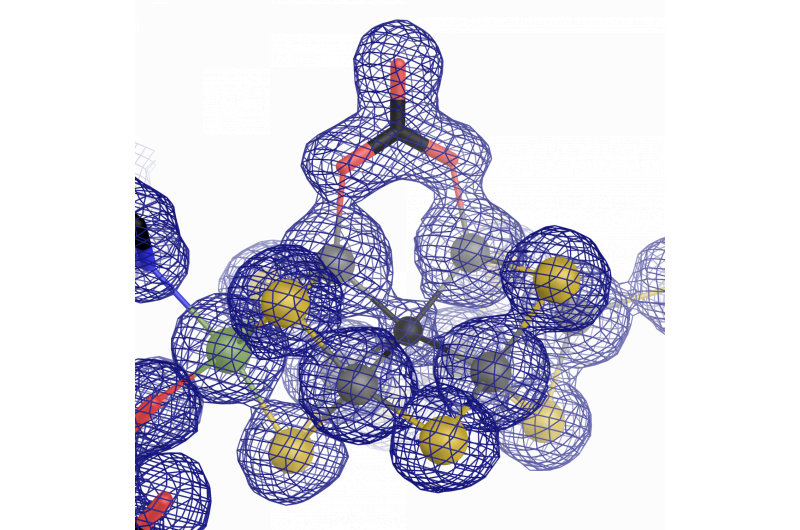
Il centro catalitico della vanadio nitrogenasi:un cofattore ferro-vanadio con un insolito legante carbonato. Credito:Oliver Einsle
Il team di ricerca del Prof. Dr. Oliver Einsle presso l'Istituto di biochimica dell'Università di Friburgo ha esplorato a lungo il funzionamento della nitrogenasi. Ora il gruppo sta introducendo la prima analisi strutturale tridimensionale della variante enzimatica che contiene vanadio. Nell'ambito della preparazione della sua tesi di dottorato, Daniel Sippel è riuscito a produrre ea cristallizzare la nitrogenasi di vanadio. Prendendo questo come base, ha usato esperimenti di diffrazione dei raggi X per chiarire la sua struttura spaziale a livello di risoluzione atomica. L'obiettivo a lungo termine del team è rendere l'azotosi biotecnologicamente utile per sviluppare alternative ai processi chimici industriali. I ricercatori hanno presentato i loro risultati sulla rivista scientifica Natura chimica biologia .
L'elemento azoto (N) è un componente chiave di tutte le macromolecole organiche. La sua disponibilità nella biosfera è limitata dal fatto che la presenza globale di azoto è confinata in gran parte al gas N2 nell'atmosfera. La stabilità di N2 lo rende inoltre inaccessibile a quasi tutti gli organismi. L'azoto biologicamente disponibile per i fertilizzanti agricoli è stato prodotto dal 1906 utilizzando il processo Haber-Bosch. Questo processo industriale converte l'azoto atmosferico (N2) in ammoniaca attraverso una reazione con l'idrogeno. Il suo significato è oggi così importante perché la produzione alimentare per più della metà della popolazione mondiale può essere garantita solo con l'aiuto di fertilizzanti azotati. In natura, solo un enzima - la nitrogenasi batterica - può ottenere la stessa reazione, ma senza emettere nell'ambiente composti azotati in eccesso, o in altre parole, lisciviazione di nitrati nelle acque sotterranee. Eppure fino ad ora, la funzione di questo complesso, Il sistema enzimatico contenente metallo che contiene metallo è stato spiegato solo in parte.
Il team di Einsle ha già compiuto un passo significativo verso una maggiore comprensione della nitrogenasi. I ricercatori sono stati in grado di inibire l'attività dell'enzima utilizzando il gas tossico monossido di carbonio (CO) per mostrare come l'inibitore si lega al cofattore ferro molibdeno (FeMoco). Conosciuto come il nucleo della nitrogenasi, è stato chiamato per gli elementi che contiene. FeMoco può catalizzare la reazione di azoto e idrogeno in una versione naturale del processo Haber-Bosch. Allo stesso tempo era noto che una variante della nitrogenasi contenente vanadio anziché molibdeno nel suo centro attivo e quindi denominata FeVco può convertire anche il monossido di carbonio. I prodotti di questa reazione sono composti di carbonio ridotti sotto forma di corte catene di carbonio. Questa reazione è la versione enzimatica di un secondo processo chimico significativo:la sintesi Fischer-Tropsch di idrocarburi che può essere utilizzata su larga scala per sintetizzare combustibili da gas di scarico industriali, ad esempio.
La vanadio nitrogenasi presente nei batteri del suolo può nel suo ambiente naturale eseguire la stessa sintesi che è possibile solo nei processi industriali con l'ausilio di pressioni estreme e alte temperature. I processi Haber-Bosch e Fischer-Tropsch vengono utilizzati ogni anno per convertire centinaia di milioni di tonnellate dei rispettivi gas - N2 e CO - rendendo possibile un'economia sostenibile, alternativa biologica di notevole interesse scientifico.
Durante il lavoro di ricerca, divenne evidente che la maggior parte dell'architettura dell'enzima era simile a quella "originale" contenente molibdeno. Tuttavia, c'è un'importante distinzione che li distingue - la struttura atomica del cofattore catalitico. Sippel ed Einsle hanno scoperto che uno ione vanadio sostituisce lo ione molibdeno in FeVco, e include un'ulteriore sostituzione di uno ione solfuro a ponte con un anione carbonato chimicamente molto diverso (μ-1, 3 carbonato:legante a ponte). Quella che inizialmente sembra essere una leggera differenza ha effetti di vasta portata sulla struttura geometrica ed elettronica del cofattore.
La ricerca è finanziata dal Consiglio europeo della ricerca (ERC) e dalla Fondazione tedesca per la ricerca (DFG) nell'ambito del gruppo di formazione alla ricerca 1976 "Functional Diversity of Cofactors" dell'Università di Friburgo e del programma prioritario "Iron-Sulfur for Vita."