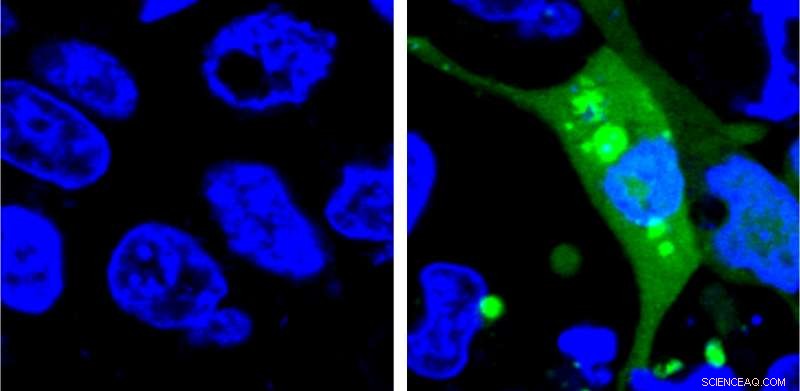
Immagine di cellule che esprimono il sensore AgHalo prima (a sinistra) e dopo (a destra) lo stress cellulare. Il sensore AgHalo si accende quando le proteine mal ripiegate iniziano ad aggregarsi e fornisce una misura quantitativa dello stress cellulare che può essere utilizzata per valutare la sicurezza dei farmaci. Credito:Yu Liu, Penn State University
Una nuova tecnica per valutare la sicurezza dei farmaci può rilevare lo stress sulle cellule in fasi precedenti rispetto ai metodi convenzionali, che si basano principalmente sulla rilevazione della morte cellulare. Il nuovo metodo utilizza un sensore fluorescente che si accende in una cellula quando le proteine mal ripiegate iniziano ad aggregarsi, un segno precoce di stress cellulare. Il metodo può essere adattato per rilevare aggregati proteici causati da altre tossine, così come malattie come l'Alzheimer o il Parkinson. Un documento che descrive il nuovo metodo, da un team di ricercatori della Penn State University, appare nel diario Angewandte Chemie Edizione Internazionale .
"Lo stress proteico indotto da farmaci nelle cellule è un fattore chiave nel determinare la sicurezza dei farmaci, " disse Xin Zhang, assistente professore di chimica e di biochimica e biologia molecolare alla Penn State, l'autore anziano dell'articolo. "I farmaci possono far sì che le proteine, che sono lunghe stringhe di amminoacidi che devono essere piegate con precisione per funzionare correttamente, si pieghino male e si raggruppino insieme in aggregati che possono eventualmente uccidere la cellula. Abbiamo deciso di sviluppare un sistema in grado di rilevare questi aggregati a nelle prime fasi e che utilizza anche una tecnologia economica e accessibile a molti laboratori."
Il nuovo sistema è il primo a utilizzare un sensore fluorescente che non si accende finché le proteine mal ripiegate non iniziano ad aggregarsi. I ricercatori hanno progettato una proteina instabile, chiamata AgHalo, etichettata con uno speciale colorante fluorescente che diventa attivo in un idrofobo, cioè idrorepellente, ambiente. Le porzioni idrofobe delle proteine sono solitamente sepolte in profondità nella struttura di una proteina correttamente ripiegata perché l'ambiente della cellula è principalmente acqua. Quando la proteina AgHalo inizia a ripiegarsi male e ad aggregarsi, il colorante può interagire con le porzioni idrofobiche della proteina e iniziare a diventare fluorescente.
I sistemi precedenti utilizzavano sensori sempre attivi. Le cellule avrebbero una fluorescenza diffusa generale prima di qualsiasi stress e i sistemi potrebbero rilevare lo stress delle proteine solo quando le proteine mal ripiegate si aggregano, formando macchie più luminose di fluorescenza che erano abbastanza grandi da essere viste al microscopio.
"Un ulteriore vantaggio del nostro sistema è che il livello di fluorescenza è correlato alla quantità di aggregazione proteica nella cellula, così possiamo quantificare il livello di stress" ha detto Yu Liu, un ricercatore post-dottorato alla Penn State e il primo autore dell'articolo. "Anche, perché il nostro metodo misura il livello di fluorescenza, piuttosto che dover identificare la fluorescenza al microscopio, può essere fatto utilizzando una tecnologia più accessibile, come lettori di targhe, ed è molto più ad alto rendimento."
I ricercatori hanno usato il loro sensore per testare il livello di stress proteico causato da cinque farmaci antitumorali comunemente usati. Sebbene nessuno dei farmaci testati causi una morte cellulare significativa nei precedenti test di sicurezza dei farmaci, tutti e cinque hanno prodotto un certo livello di stress proteico rilevabile dal sensore AgHalo.
"Poiché abbiamo testato i farmaci antitumorali a dosi molto più elevate di quelle normalmente utilizzate per il trattamento, i nostri risultati non mettono necessariamente in discussione l'uso continuato di questi farmaci, " disse Liu. "Tuttavia, perché lo stress proteico da trattamenti a lungo termine potrebbe avere effetti duraturi, valutare i farmaci con il nostro nuovo sensore aiuterà nello sviluppo di farmaci più sicuri".
Lo stress proteico può essere indotto da molti altri fattori. Calore, tossine, infezioni batteriche, cancro, e anche l'invecchiamento può causare il ripiegamento errato delle proteine e la formazione di aggregati nelle cellule. "Con il nostro metodo, possiamo rilevare quantitativamente lo stress proteico nelle cellule in fasi molto più precoci e quindi i ricercatori possono iniziare a studiare i meccanismi che le cellule usano per combattere questo stress e sviluppare composti che possono migliorare la capacità della cellula di gestire lo stress proteico, " disse Zhang.