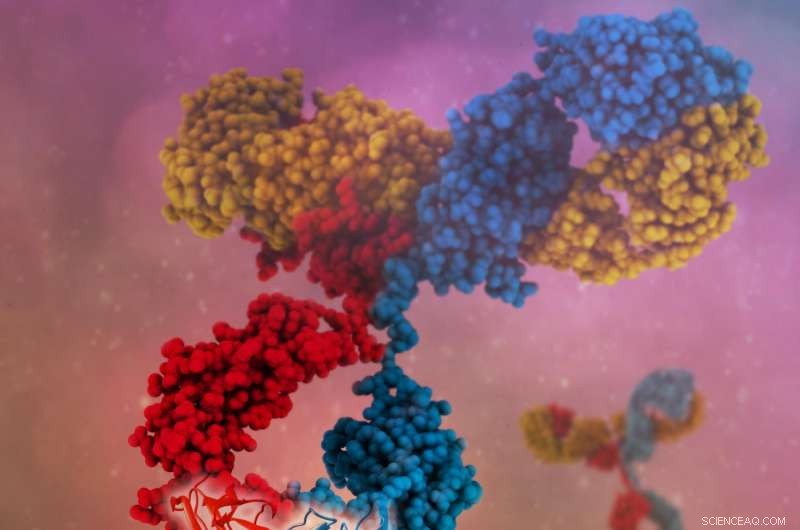
Un singolo anticorpo bispecifico può legarsi a più antigeni, con conseguente targeting più specifico, nuovi meccanismi d'azione e maggiore efficacia clinica. Crediti:Camilla De Nardis, Linda J. A. Hendriks, Emilie Poirier, Tudor Arvinte, Piet Gros, Alexander B.H. Bakker e John de Kruif
Un gruppo di ricercatori ha sviluppato un approccio per produrre in modo efficiente anticorpi in grado di legarsi contemporaneamente a due diverse molecole bersaglio, un'innovazione a lungo desiderata nel campo dell'immunoterapia del cancro. I dettagli saranno pubblicati nel numero del 1 settembre del Journal of Biological Chemistry .
Gli anticorpi sono proteine prodotte dal sistema immunitario specializzate nel riconoscimento e nel legame a bersagli molecolari unici dei batteri, virus o altre cellule estranee. Poiché gli anticorpi sono stabili e duraturi nel corpo umano e possono riconoscere con precisione obiettivi specifici, sono stati sfruttati per sviluppare nuovi trattamenti per le malattie. Per esempio, anticorpi modificati possono essere utilizzati per legarsi a bersagli nelle cellule tumorali, reclutare il sistema immunitario per attaccare il cancro o impedire alle cellule tumorali di moltiplicarsi. A causa della loro precisione e capacità di stimolare la risposta immunitaria dell'organismo, le terapie a base di anticorpi in genere hanno meno effetti collaterali rispetto alla chemioterapia o alle radiazioni.
Gli anticorpi sono a forma di "Y", e in genere legano un bersaglio, o antigene, attraverso la punta di ciascun braccio della "Y". Negli anticorpi prodotti naturalmente, entrambi i bracci di un singolo anticorpo sono tipicamente gli stessi e si legano allo stesso bersaglio. Un approccio per aumentare la versatilità delle terapie anticorpali consiste nell'ingegnerizzare i cosiddetti anticorpi bispecifici, in cui ogni braccio si lega a una molecola diversa. Questo amplia la gamma di ciò per cui gli anticorpi possono essere utilizzati. Per esempio, un anticorpo bispecifico potrebbe colpire un gruppo di proteine costituito da più tipi di proteine, oppure potrebbe mettere insieme due diverse molecole o tipi di cellule.
Un farmaco bispecifico simile all'anticorpo - il farmaco per la leucemia blinatumomab - è attualmente sul mercato. Ma lo sviluppo di più terapie basate su anticorpi bispecifici è stato ostacolato da sfide tecniche. Per esempio, alcuni anticorpi bispecifici deviano dalla forma a Y standard e tendono ad essere meno stabili degli anticorpi convenzionali, cadendo a pezzi facilmente. Ulteriore, alcuni formati di anticorpi bispecifici tendono ad essere difficili da produrre su scala industriale perché possono richiedere processi ingegneristici specializzati.
Negli esperimenti pubblicati su JBC, una squadra supervisionata da John de Kruif, il chief technology officer della società di ricerca in fase clinica Merus N.V., anticorpi bispecifici migliorati apportando alcune modifiche chiave alla struttura degli anticorpi naturali dell'immunoglobulina G (IgG) umana, e mostrò che potevano essere facilmente fabbricati. L'IgG è un anticorpo ben studiato ed è il più abbondante prodotto nel corpo umano.
"Noi abbiamo fatto, in una molecola IgG completa, solo quattro cambiamenti per passare da un normale anticorpo monospecifico a un anticorpo bispecifico, " ha detto de Kruif. "La cosa bella è che assomiglia così tanto a un normale anticorpo che possiamo produrlo bene e crediamo di sapere come si comporterà".
Le quattro mutazioni erano nei componenti proteici "a catena pesante" degli anticorpi. Tipicamente, due catene pesanti identiche si accoppiano in ciascun anticorpo. La sfida nella creazione di anticorpi bispecifici era quella di indurre catene pesanti non identiche ad accoppiarsi, creando "braccia" in grado di legare antigeni diversi, scoraggiando l'accoppiamento di quelli identici.
L'idea del team era di introdurre amminoacidi con cariche opposte alle due diverse catene pesanti, in modo che catene pesanti identiche si respingano mentre le catene pesanti cariche positivamente e negativamente si attraggono. Per individuare le giuste sedi in cui introdurre tali addebiti, hanno utilizzato simulazioni computazionali utilizzando un software di screening virtuale seguito dalla convalida in laboratorio.
"L'utilizzo del software di screening virtuale ha fornito una linea di base, " disse Linda Kaldenberg-Hendriks di Merus, che ha condotto il test degli anticorpi. "Abbiamo identificato potenziali buoni candidati per le scelte di progettazione nei set di catene pesanti, quindi ha generato le proteine e le ha caratterizzate accuratamente. Quando abbiamo visto che si stavano comportando come volevamo, è stato davvero soddisfacente".
Il team ha anche studiato la struttura molecolare degli anticorpi bispecifici, e ha confermato che le mutazioni hanno provocato solo cambiamenti molto sottili nella "spina dorsale" delle catene pesanti, che può spiegare la stabilità di questi anticorpi bispecifici.
"Un punto di forza [di questo studio] è stato quello di combinare diversi approcci, gli strumenti di calcolo con la biochimica e la biologia strutturale, " ha detto Camilla De Nardis della Merus e dell'Università di Utrecht, che è stato uno degli autori principali dello studio.
Le proteine che hanno lavorato si sono accoppiate per formare anticorpi bispecifici, con pochissimi o nessun anticorpi monospecifici nella miscela. Il team li ha poi sottoposti a una serie di test, confermando che erano stabili quanto gli anticorpi IgG normali e avevano proprietà farmacocinetiche simili.
Poiché la produzione e la purificazione degli anticorpi IgG è un processo industriale consolidato, il team potrebbe semplicemente fornire ai produttori le sequenze proteiche modificate con i cambiamenti chiave che hanno permesso alle proteine di formare bispecifiche. "Crediamo di poter produrre praticamente qualsiasi anticorpo bispecifico che vogliamo, " ha detto Kaldenberg-Hendriks.
Gli anticorpi bispecifici del team mirati ai complessi del fattore di crescita delle cellule tumorali sono ora in fase di sperimentazione clinica, con altri ancora in fase preclinica. Il team è entusiasta del potenziale del formato versatile da adattare a diversi tipi di terapie.
"Gli anticorpi sono in grado di essere così specifici, e puoi modificarli e metterli a punto, " ha detto Kaldenberg-Hendriks. "Con anticorpi bispecifici, crediamo di poter scegliere le affinità di entrambe le braccia e bilanciarle in modo da poter colpire più specificamente i tumori, e recluta anche altre cellule o molecole per attaccare le cellule tumorali senza molti effetti collaterali. Pensiamo davvero che sia la strada da seguire".