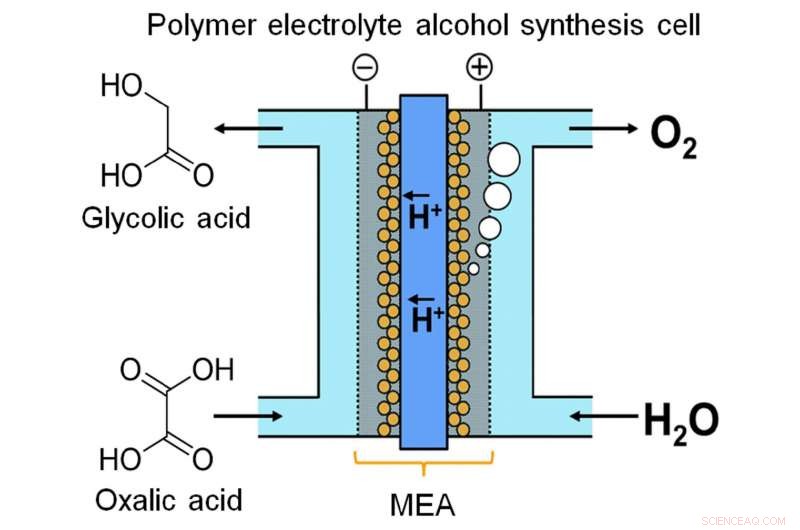
Un team di ricerca dell'Università di Kyushu ha realizzato la sintesi elettrochimica continua di un composto alcolico da un acido carbossilico utilizzando una cella di elettrosintesi dell'alcool con elettrolita polimerico, che consente la carica diretta di energia nel composto alcolico. Credito:Masaaki Sadakiyo / Istituto internazionale per la ricerca sull'energia a emissioni zero, Università di Kyushu
L'interesse per le energie rinnovabili continua a crescere. Molte rinnovabili, anche se, può essere frustrantemente intermittente. Quando il sole è oscurato dalle nuvole, o il vento smette di soffiare, la potenza oscilla. L'offerta fluttuante può essere in parte compensata dall'accumulo di energia durante i periodi di picco di produzione. Però, immagazzinare elettricità non è esente da sfide.
Recentemente, un team dell'Università di Kyushu ha creato un dispositivo per immagazzinare energia in forma chimica attraverso l'elettrolisi continua. I ricercatori hanno notato che l'acido glicolico (GC) ha una capacità energetica molto maggiore dell'idrogeno, uno dei più popolari prodotti chimici per l'accumulo di energia. GC può essere prodotto dalla riduzione a quattro elettroni dell'acido ossalico (OX), un acido carbossilico ampiamente disponibile. Come descritto nella loro pubblicazione in Rapporti scientifici , il team ha ideato una cella elettrolitica basata su un nuovo gruppo membrana-elettrodo. Stretti tra due elettrodi sono un anodo a base di ossido di iridio e un catodo di titanio (Ti) rivestito di biossido di titanio (TiO2), legati da una membrana polimerica.
"I sistemi di tipo a flusso sono molto importanti per lo stoccaggio di energia con reazione in fase liquida, " afferma l'autore principale Masaaki Sadakiyo. "La maggior parte degli elettrolizzatori che producono alcoli utilizzano un processo batch, che non è adatto a questo scopo. Nel nostro dispositivo, utilizzando un elettrolita polimerico solido a diretto contatto con gli elettrodi, possiamo eseguire la reazione come un flusso continuo senza aggiunta di impurità (es. elettroliti). La soluzione OX può essere effettivamente pensata come un pool di elettroni fluido".
Un'altra considerazione chiave è il design del catodo. La reazione catodica è catalizzata da anatasio TiO2. Per garantire un solido collegamento tra catalizzatore e catodo, il team ha "coltivato" TiO2 direttamente su Ti sotto forma di rete o feltro. Le immagini al microscopio elettronico mostrano il TiO2 come una peluria sottile, aggrappandosi all'esterno delle barre di Ti come un rivestimento di neve fresca. Infatti, il suo compito è di catalizzare l'elettroriduzione di OX a GC. Nel frattempo, all'anodo, l'acqua viene ossidata ad ossigeno.
Il team ha scoperto che la reazione accelerava a temperature più elevate. Però, alzare troppo il calore ha incoraggiato un sottoprocesso indesiderato:la conversione dell'acqua in idrogeno. L'equilibrio ideale tra questi due effetti era a 60°C. A questa temperatura, il dispositivo potrebbe essere ulteriormente ottimizzato rallentando il flusso dei reagenti, aumentando la quantità di superficie disponibile per la reazione.
interessante, anche la trama del catalizzatore sfocato TiO2 ha fatto una grande differenza. Quando il TiO2 è stato preparato come un "feltro, " coltivandolo su barre di Ti più sottili e più dense, la reazione è avvenuta più velocemente che sulla rete, probabilmente a causa della maggiore area superficiale. Il feltro scoraggiava anche la produzione di idrogeno, ricoprendo la superficie del Ti in modo più aderente rispetto alla rete, prevenire l'esposizione del Ti nudo.
"Nelle giuste condizioni, la nostra cellula converte quasi il 100% di OX, che troviamo molto incoraggiante, ", afferma il coautore Miho Yamauchi. "Calcoliamo che la capacità energetica volumetrica massima della soluzione GC è circa 50 volte quella del gas idrogeno. Per essere chiari, l'efficienza energetica, al contrario della capacità, è ancora indietro rispetto ad altre tecnologie. Però, questo è un promettente primo passo verso un nuovo metodo per immagazzinare la corrente in eccesso."