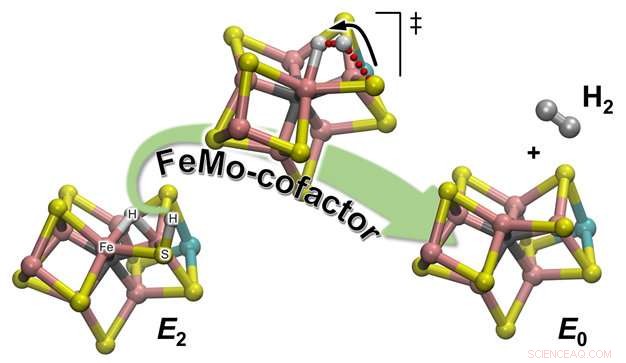
Illustrazione schematica di come si forma H2 da uno degli intermedi enzimatici di reazione (E2) per rigenerare lo stato di riposo (E0) del cofattore catalitico nitrogenasi, chiamato FeMo-cofattore. L'atomo di idrogeno legato ad uno degli atomi di zolfo avvia un viaggio che lo porterà ad incontrare il partner con il quale formerà la molecola H2:un idrogeno idrico in paziente attesa, seduto tra due atomi di Fe. Credito:Pacific Northwest National Laboratory
La nitrogenasi è fondamentale per la vita sul nostro pianeta. Fornisce la maggior parte dell'azoto (N) utilizzato nelle proteine e negli acidi nucleici ed è essenziale nella creazione delle piante, animali e altri organismi, producendo ammoniaca (NH3) che viene poi utilizzata nella biosintesi degli amminoacidi e poi delle proteine. Ma mentre la nitrogenasi è al lavoro, sta anche creando qualcos'altro:diidrogeno (H2). Gli scienziati sanno da tempo che la nitrogenasi produce H2 attraverso due processi diversi. Ora, uno di questi processi è evidente grazie al lavoro di un team di ricercatori che ha studiato il meccanismo per la produzione di H2.
La nitrogenasi produrrà H2 se eseguita in assenza di N2. Questo è stato visto come un "rilassamento" del sito attivo dell'enzima che è caricato con idruri di ferro necessari per la reazione di riduzione dell'N2. Ma qual è il meccanismo per cui gli idruri di ferro del sito attivo della nitrogenasi si sono rilassati per produrre questo H2? Un team di scienziati del Pacific Northwest National Laboratory, Università statale dello Utah, Università nordoccidentale, e l'Università dello Utah ha cercato di comprendere questo meccanismo di rilassamento dell'H2 monitorando gli effetti dell'idrogeno (H) rispetto al deuterio (D) sulla cinetica della formazione di H2 quando la nitrogenasi è attaccata a un elettrodo. Il team ha scoperto che un vicino H+ era in realtà il partner attivo nella produzione di H2 quando si combina con l'idruro di ferro per produrre H2.
"Solo un protone fa tutto, l'idruro è solo un semplice spettatore in attesa di qualche azione, " ha confermato Simone Raugei, uno scienziato del PNNL coinvolto in questo lavoro.
Questo è un passo importante verso la comprensione della nitrogenasi e come e perché la produzione di H2 è richiesta per la sua attività. Illustra anche una strategia per lo studio meccanicistico che può essere applicata ad altri enzimi ossidoreduttasi ea complessi biomimetici.
Per isolare la cinetica della produzione di idrogeno, una squadra guidata da Lance Seefeldt, Brian Hoffman, Shelley Minteer, e Simone Raugei hanno usato piccole molecole per trasportare rapidamente gli elettroni da un elettrodo alla metà catalitica della nitrogenasi. Seguire le reazioni del protone era un compito difficile e impegnativo, disse Seefeldt, quindi, per garantire l'accuratezza, hanno monitorato l'"inventario" di protoni (il numero di idrogeni coinvolti nella produzione catalitica di H2) eseguendo misurazioni cinetiche di idrogeno/deuterio.
I risultati degli esperimenti hanno suggerito che solo un idrogeno era effettivamente coinvolto nella fase limitante della formazione di H2, e non due come indica la stechiometria della reazione.
Le osservazioni sperimentali del team sono state confermate attraverso la chimica computazionale, che ha fornito una dettagliata descrizione atomistica del meccanismo di reazione. Ci sono 2 tipi di idrogeni nel cofattore catalitico (chiamato FeMo-co):uno situato in una posizione a ponte dove si lega a due atomi di ferro (un idruro a ponte), e uno su un vicino atomo di zolfo ligandi (fondamentalmente un atomo di zolfo protonato:S-H). Si scopre che durante l'evoluzione di H2, quest'ultimo è il partner attivo. Il legame S-H si rompe e l'H+ risultante si sposta verso l'idruro a ponte e lo protona formando H2:I calcoli forniscono una spiegazione dell'osservazione sperimentale che solo un idrogeno è "attivo, " mentre l'altro è un semplice spettatore in attesa dell'arrivo del suo partner.
"Il livello di accordo tra le osservazioni e i risultati della chimica computazionale era notevolmente alto, " disse Raugei.
Questo lavoro è un passo fondamentale verso una comprensione meccanicistica dell'enzima nitrogenasi. C'è ancora del lavoro da fare per comprendere il meccanismo dell'altro processo di evoluzione dell'H2 che porta al legame di N2, Attivazione, e riduzione a NH3.