Credito:CEA
Dopo 40 anni di ricerca, ricercatori del CEA, CNRS, Università di Grenoble-Alpi, L'Università di Montpellier e l'Inserm hanno finalmente identificato l'enzima responsabile della detirosinazione della tubulina. Sorprendentemente, non è un enzima ma due che controllano la modifica di questo componente essenziale della struttura del citoscheletro. Questo lavoro apre nuove prospettive per una migliore comprensione del ruolo svolto dalla tubulina, la cui deregolamentazione è stata collegata ai tumori, malattie cardiovascolari e disturbi neurali.
Un progetto collaborativo internazionale che coinvolge ricercatori della CEA (Commissione francese per l'energia atomica), CNRS (Centro Nazionale Francese per la Ricerca Scientifica), Inserm (Istituto nazionale francese di salute e ricerca medica), Università di Grenoble-Alpi, L'Università di Montpellier e la Stanford University hanno identificato l'enzima, Tubulina CarbossiPeptidasi (TCP), responsabile della trasformazione biochimica dei microtubuli cellulari, attraverso la detirosinazione. La detirosinazione è una reazione biologica che porta alla rimozione dell'aminoacido tirosina terminale dall'α-tubulina, una delle subunità che compongono i microtubuli. Dopo quattro decenni di ricerche, i biologi sono finalmente riusciti a purificare questa proteina, e hanno continuato a fornire prove della sua attività cellulare.
I microtubuli contribuiscono alle funzioni cellulari essenziali
I microtubuli sono fibre dinamiche presenti in tutte le cellule, sono formati dalla combinazione di due proteine (α-tubulina e β-tubulina). I microtubuli svolgono numerose funzioni:separano i cromosomi per distribuirli tra le due cellule figlie durante la divisione cellulare; contribuiscono alla polarità cellulare, morfologia e alla migrazione cellulare; formano anche una rete all'interno della cellula, su quali costituenti cellulari, come proteine o filamenti di RNA, può essere trasportato.
Queste funzioni cellulari sono regolate da "segnali" che sono presenti sulla superficie dei microtubuli. Questi segnali, consistenti in modificazioni biochimiche degli amminoacidi (note come modificazioni post-traduzionali, come avvengono dopo la sintesi proteica), si verificano in più siti nelle cellule e sono eseguiti da un'ampia gamma di enzimi; in questo caso, gli enzimi modificano le tubuline.
L'enzima TCP, finalmente identificato dopo 40 anni di mistero
L'attività di uno di questi enzimi è stata identificata per la prima volta nel 1977 da un gruppo di ricerca argentino. Hanno chiamato questa attività "TCP" (Tubulin CarboxyPeptidase). È stato dimostrato che questo enzima esegue la reazione di detirosinazione:rimozione dell'aminoacido terminale, una tirosina, dalla fine dell'α-tubulina, ma la proteina stessa restava da identificare (le sue dimensioni e la sua sequenza erano sconosciute). Un altro enzima, la ligasi TTL, compie la reazione inversa – tirosinazione – attraverso la quale la tirosina viene sostituita. Il ciclo di detirosinazione/tirosinazione è vitale per la cellula e per l'organismo nel suo insieme. La detirosinazione massiccia (anormale) è osservata in un certo numero di tipi di cancro gravi e nelle malattie cardiovascolari.
L'identificazione e la caratterizzazione del TCP era quindi un obiettivo importante per i ricercatori che desideravano comprendere la funzione fisiologica della detirosinazione dell'α-tubulina e determinare le conseguenze della sua inibizione.
Per isolare TCP, i ricercatori ne hanno monitorato l'attività, utilizzate tecniche biochimiche convenzionali, e ha collaborato con i chimici della Stanford University, che sviluppò una piccola molecola inibendone l'attività. Questa molecola è stata poi usata come esca per "intrappolare" l'elusivo enzima.
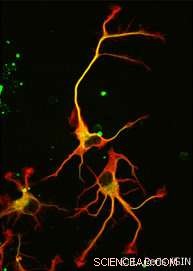
Alla fine, non uno, ma furono scoperti due enzimi. VASH1 e VASH2 erano già noti agli scienziati, ma non erano stati precedentemente associati al citoscheletro. I ricercatori hanno dimostrato che, quando associato a una proteina partner chiamata SVBP, VASH1 e VASH2 possono causare la detirosinazione dell'α-tubulina. Per dimostrare questa attività, il team ha inibito l'espressione di VASH1/2 (o del loro partner SVBP) nei neuroni. In entrambi i casi, è stato osservato un calo molto forte del livello di detirosinazione dell'α-tubulina insieme ad un'alterata morfologia neuronale (vedi Figura). I ricercatori hanno poi dimostrato che questi enzimi sono coinvolti anche nello sviluppo della corteccia cerebrale.
Così, 40 anni dopo la presentazione della prima prova di detirosinazione dell'α-tubulina, sono stati identificati gli enzimi responsabili. Gli scienziati ora sperano che, modulando l'attività del TCP e migliorando la loro conoscenza del ciclo di detirosinazione/tirosinazione, saranno in grado di sviluppare nuovi trattamenti per tumori specifici, e per ottenere una migliore comprensione delle sue funzioni cerebrali e cardiache.