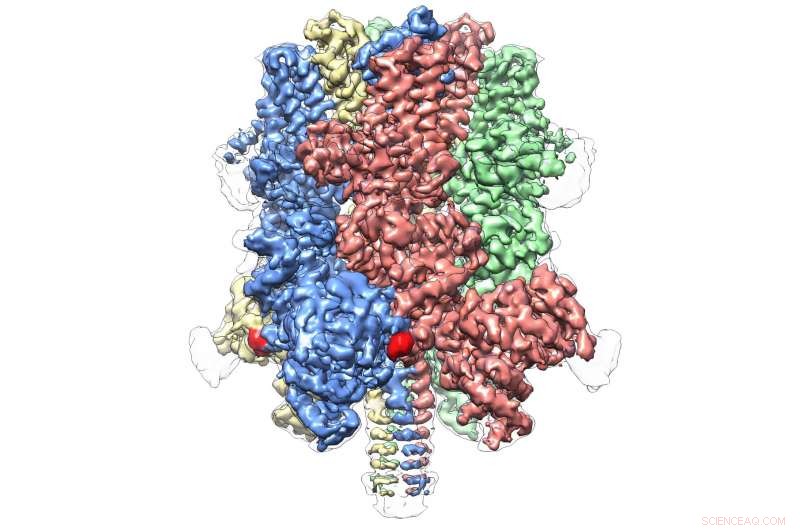
TRPM4 umano legato con l'agonista Ca+ e modulatore TVP a 3,8 Å. Credito:Wei Lu, dottorato di ricerca
Un team guidato da scienziati del Van Andel Research Institute (VARI) ha rivelato per la prima volta la struttura a livello atomico di un promettente bersaglio farmacologico per condizioni come ictus e lesioni cerebrali traumatiche.
Chiamato TRPM4, questa proteina si trova nei tessuti di tutto il corpo, compreso il cervello, cuore, rene, colon e intestino, dove svolge un ruolo importante nella regolazione del flusso sanguigno tramite la costrizione dei vasi sanguigni, nonché nell'impostazione del ritmo cardiaco e nella moderazione delle risposte immunitarie.
"Capire il ruolo che TRPM4 svolge nella regolazione della circolazione è vitale, ma per anni la ricerca è stata limitata dalla mancanza di informazioni sulla sua architettura molecolare, " disse Wei Lu, dottorato di ricerca, un assistente professore al VARI e autore principale di uno studio che descrive la struttura di TRPM4, pubblicato oggi in Natura . "I nostri risultati non solo forniscono una dettagliata, mappa a livello atomico di questa proteina critica, ma rivelano anche sfaccettature completamente inaspettate del suo trucco".
TRPM4 è coinvolto in modo critico nella regolazione dell'afflusso di sangue al cervello, che comprende solo circa il 2 percento del peso totale del corpo, ma riceve dal 15 al 20 percento del suo apporto di sangue. Condizioni che interrompono il flusso sanguigno nel cervello, come l'ictus, trauma cranico, edema cerebrale e ipertensione, possono avere conseguenze devastanti e sono importanti problemi di salute pubblica.
"Nel sistema circolatorio del cervello esistono molte protezioni per proteggersi da un'improvvisa interruzione dell'afflusso di sangue, uno dei quali è TRPM4, Lü ha detto. "Speriamo che una migliore comprensione dell'aspetto di questa proteina possa fornire agli scienziati un modello molecolare su cui basare la progettazione di farmaci più efficaci con meno effetti collaterali".
La struttura di TRPM4 è nettamente diversa dalle altre molecole della superfamiglia TRP, una categoria di proteine che mediano le risposte alle sensazioni e agli stimoli sensoriali, come il dolore, pressione, visione, temperatura e gusto. Ampiamente conosciuti come canali ionici, proteine come il TRP si annidano all'interno delle membrane delle cellule, fungendo da gatekeeper per i segnali chimici che entrano ed escono dalla cellula.
Anche all'interno della propria sottofamiglia, che comprende otto molecole in totale, TRPM4 sembra essere del tutto unico. La pubblicazione di oggi rappresenta la prima vista atomica di un membro della sottofamiglia TRPM.
Rivela una struttura a corona, con i quattro picchi che compongono un grande dominio N-terminale, un segno distintivo delle proteine TRPM. Questa regione, trova all'inizio della molecola, è un importante sito di interazione con l'ambiente cellulare e altre molecole nel corpo. All'estremità opposta di TRPM4, comunemente chiamato dominio C-terminale, Il team di Lü ha trovato una struttura a ombrello supportata da un "palo" e quattro "costole" elicoidali, caratteristiche mai osservate prima.
I risultati sono stati resi possibili dalla David Van Andel Advanced Cryo-Electron Microscopy Suite all'avanguardia di VARI, che consente agli scienziati di visualizzare alcuni dei più piccoli componenti della vita con dettagli squisiti. Il più grande microscopio di VARI, il Titano Krios, è uno dei meno di 120 al mondo ed è così potente che può visualizzare molecole 1/10, 000esimo della larghezza di un capello umano.
La struttura di Lü è la seconda struttura molecolare determinata sul Krios dell'Istituto dal completamento dell'installazione della suite all'inizio di quest'anno.