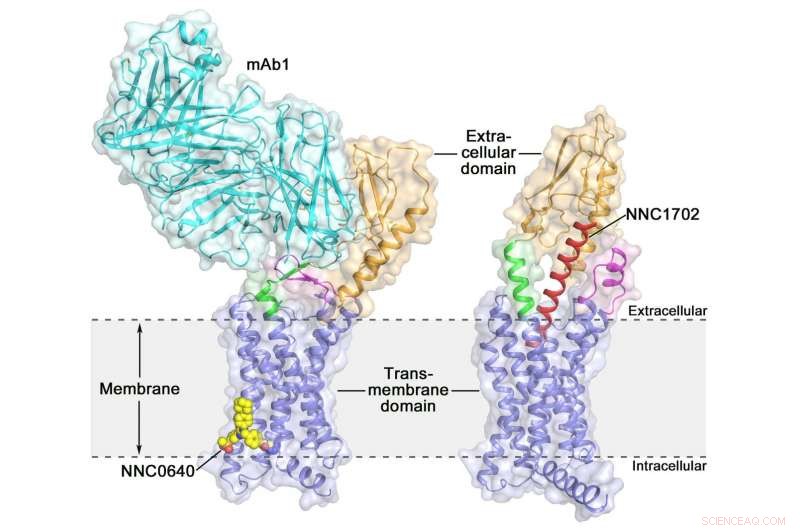
La struttura cristallina del recettore del glucagone umano a lunghezza intera (GCGR) struttura cristallina del recettore del glucagone umano a lunghezza intera (GCGR):arancione (dominio extracellulare), blu (dominio transmembrana), verde (gambo), magenta (il primo ciclo extracellulare), rosso (NNC1702), giallo (NNC0640) e ciano (mAb1) Credito:Dr. WU Beili
I recettori accoppiati a proteine G di classe B (GPCR) esercitano un'azione essenziale nell'omeostasi ormonale e sono importanti bersagli terapeutici per una varietà di malattie tra cui disturbi metabolici come il diabete di tipo 2. Questi recettori sono costituiti da un dominio extracellulare (ECD) e da un dominio transmembrana (TMD), entrambi sono necessari per interagire con i loro ligandi peptidici affini e per regolare la trasduzione del segnale a valle. A causa delle difficoltà nella preparazione di proteine di alta qualità, la determinazione della struttura dei GPCR di classe B integrale rimane una sfida, limitando così la comprensione dei meccanismi molecolari dell'azione dei recettori.
L'attivazione del recettore del glucagone umano (GCGR) da parte del suo ligando endogeno glucagone innesca il rilascio di glucosio dal fegato durante il digiuno, rendendolo un potenziale bersaglio farmacologico per il diabete di tipo 2. L'anno scorso, un gruppo di scienziati dello Shanghai Institute of Materia Medica (SIMM) dell'Accademia cinese delle scienze ha determinato la struttura cristallina del GCGR a lunghezza intera legato a un modulatore allosterico negativo NNC0640 e a un anticorpo inibitorio mAb1, fornendo così per la prima volta un'immagine chiara di un GPCR di classe B a tutta lunghezza ad alta risoluzione.
Recentemente, gli scienziati del SIMM hanno determinato la struttura cristallina di GCGR in complesso con un analogo del glucagone e l'agonista parziale NNC1702. Questa struttura rivela, per la prima volta, i dettagli molecolari di un GPCR di classe B che si lega al suo ligando peptidico ad alta risoluzione e rivela inaspettatamente la complessità strutturale che governa l'attivazione del recettore, ampliando così notevolmente la comprensione della trasduzione del segnale GPCR di classe B. Lo studio è stato pubblicato su Natura .
Questo studio offre alcune preziose informazioni sul meccanismo di attivazione di GCGR. La scoperta più interessante è che la regione linker che collega l'ECD e il TMD del recettore, chiamato il "gambo, " e il primo ciclo extracellulare subisce significativi cambiamenti conformazionali nelle loro strutture secondarie nella struttura GCGR legata al peptide rispetto alla struttura non legata al peptide precedentemente determinata. Ciò porta a un marcato cambiamento nell'orientamento relativo tra l'ECD e il TMD del recettore per accogliere il legame del peptide e avviare l'attivazione del recettore.
Per di più, lo stelo può modulare l'attività del recettore facilitando i movimenti conformazionali del recettore TMD. "È sorprendente osservare come la regione del gambo svolga un ruolo così importante nella regolazione della funzione del recettore, sebbene contenga solo 12 amminoacidi, " ha detto il professor ZHAO Qiang del professor SIMM. "Questo non è mai stato osservato negli studi strutturali GPCR precedentemente risolti. Approfondisce significativamente la conoscenza dei meccanismi di segnalazione GPCR di classe B."
Basato sulla struttura del complesso GCGR-NNC1702, i ricercatori hanno eseguito una serie di studi funzionali utilizzando tecniche come il legame competitivo di ligandi, segnalazione cellulare, simulazioni di dinamica molecolare e spettroscopia a doppia risonanza elettrone-elettrone. I risultati supportano la struttura del GCGR e confermano le alterazioni conformazionali del recettore in diversi stati funzionali.
"La struttura GCGR appena risolta fornisce il modello più accurato fino ad oggi per la progettazione di farmaci mirati a GCGR, che offre nuove opportunità nella scoperta di farmaci per il trattamento del diabete di tipo 2, " ha detto il capo squadra e professore SIMM Dr. WU Beili.