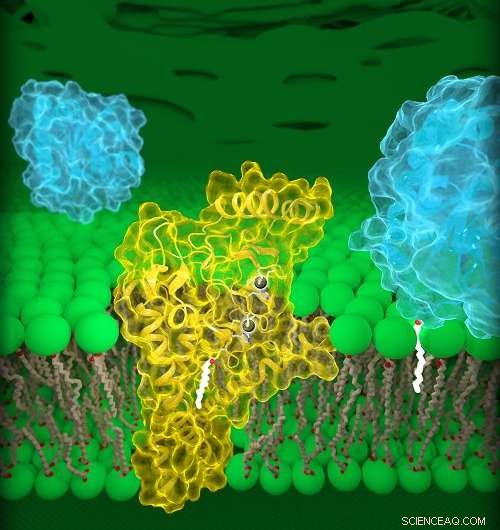
Il DHHC20 umano (giallo) è incorporato nella membrana del Golgi (verde), un vano situato all'interno delle celle. DHHC20 lega una catena di acidi grassi (bianca) a una proteina bersaglio (blu, primo piano), che ancora la proteina alla membrana del Golgi. Credito:Jeremy Swan, NICHD/NIH
La prima struttura tridimensionale delle proteine DHHC, enzimi coinvolti in molti processi cellulari, compreso il cancro, spiega come funzionano e può offrire un modello per la progettazione di farmaci terapeutici. I ricercatori hanno proposto di bloccare l'attività del DHHC per aumentare l'efficacia dei trattamenti di prima linea contro le forme comuni di cancro al polmone e al seno. Però, attualmente non ci sono farmaci autorizzati che hanno come target specifici enzimi DHHC. Lo studio, guidato da ricercatori dell'Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD), appare nell'ultimo numero di Scienza .
enzimi DHHC, chiamate anche palmitoiltransferasi, modificare altre proteine legando ad esse una catena di lipidi, o acidi grassi, di varia lunghezza. Questa modifica, chiamato palmitoilazione, può modificare molte proprietà di una proteina bersaglio, come la sua struttura, funzione e posizione all'interno di una cellula. I ricercatori stimano che quasi 1, 000 proteine umane subiscono palmitoilazione, compresi i recettori del fattore di crescita epidermico (EGFR). Un noto EGFR è HER2, che è iperattivato nelle forme aggressive di cancro al seno. Gli EGFR possono anche essere iperattivati nel cancro del colon, e cancro del polmone non a piccole cellule, il tipo più comune di cancro ai polmoni.
L'attuale studio descrive in dettaglio le strutture di un enzima DHHC umano, DHHC20, e la versione zebrafish di un altro enzima DHHC, DHHC15. È importante sottolineare che DHHC20 è l'enzima che palmitoila l'EGFR. Precedenti studi hanno dimostrato che il blocco di DHHC20 rende le cellule tumorali più vulnerabili ai trattamenti esistenti approvati dalla FDA che prendono di mira l'EGFR. Perciò, comprendere la struttura di DHHC20 può essere importante per il trattamento dei tumori guidati da EGFR.
"Le mutazioni negli enzimi DHHC sono associate a vari tipi di cancro e disturbi neurologici, "secondo Anirban Banerjee, dottorato di ricerca, l'autore principale dello studio e capo dell'Unità di NICHD sulla biologia strutturale e chimica delle proteine di membrana. "Il nostro studio offre un punto di partenza per lo sviluppo di inibitori DHHC20 che possono aiutare nel trattamento dei tumori comuni e far progredire il campo della palmitoilazione proteica".
Il Dr. Banerjee e colleghi hanno identificato un componente strutturale, una cavità, di DHHC20 che influenza la lunghezza della sua catena lipidica. Le mutazioni che hanno alterato la dimensione relativa di questa cavità hanno fatto sì che DHHC20 utilizzasse catene lipidiche più corte o più lunghe, che presumibilmente modifica gli effetti della palmitoilazione su una proteina bersaglio. I ricercatori propongono che la struttura di questo sito spieghi perché diversi enzimi DHHC utilizzano determinate catene lipidiche per modificare le funzioni di altre proteine. Offre anche informazioni su come più enzimi lavorano insieme in stati di salute e malattia.