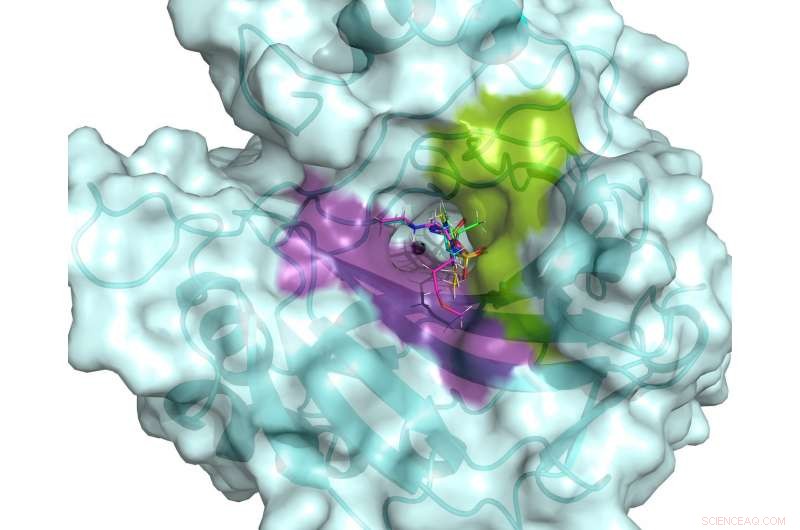
Il sito attivo di hCA II. Il sito attivo è fiancheggiato da tasche di legame idrofile (viola) e idrofobe (verde) che possono essere utilizzate per progettare farmaci specifici mirati alle hCA associate al cancro. Cinque farmaci clinici sono mostrati sovrapposti nel sito attivo di hCA II, basato su strutture di neutroni a temperatura ambiente. Attestazione:ORNL/Andrey Kovalevsky
Nuove intuizioni dall'analisi dei neutroni dei farmaci per il glaucoma e del loro bersaglio enzimatico possono aiutare gli scienziati a progettare farmaci che colpiscano in modo più efficace i tumori aggressivi.
Un team di ricercatori guidati dall'Oak Ridge National Laboratory del Dipartimento dell'Energia ha utilizzato la cristallografia macromolecolare di neutroni per studiare i diversi stati di tre farmaci per il glaucoma mentre interagiscono con l'enzima mirato, anidrasi carbonica umana II (hCA II).
"Il nostro obiettivo era osservare le differenze nella presentazione di tre farmaci per il glaucoma usati clinicamente mentre sono legati all'enzima hCA II, " ha detto Andrey Kovalevsky, uno scienziato degli strumenti presso l'ORNL e un coautore senior dello studio. "Osservando quanto bene questi farmaci prendono di mira l'hCA II in protonato, stati neutri e deprotonati, speravamo di ottenere informazioni che consentissero di migliorare questi farmaci in modo che possano indirizzare meglio gli enzimi legati al cancro".
La protonazione si riferisce alla presenza, aggiunta o perdita di un protone, che conferisce al farmaco un aspetto neutro, carica positiva o negativa, rispettivamente. Alterare la carica di un farmaco potrebbe cambiare la sua capacità di riconoscere e legarsi con la sua proteina bersaglio e, di conseguenza, la sua efficacia.
Lo studio, pubblicato sulla rivista Struttura , trovato che la temperatura, pH, e la carica elettrica dei tre farmaci per il glaucoma ha influenzato la loro capacità di mirare e legarsi con l'enzima hCA II.
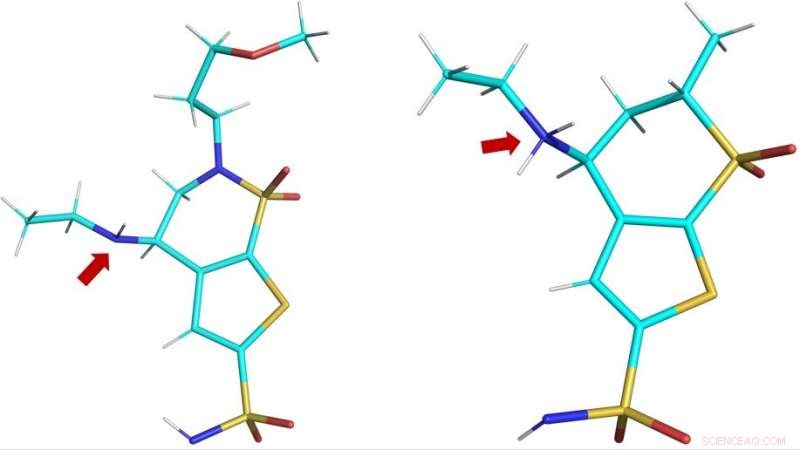
Strutture tridimensionali dei farmaci clinici brinzolamide (BZM, a sinistra) e dorzolamide (DZM, a destra) come osservato nel sito attivo di hCA II. La freccia rossa mostra i gruppi amminici dei farmaci:in BZM, l'atomo di azoto (in blu) non è protonato e quindi non è carico; in DZM, l'atomo di azoto ha accettato un protone in più e quindi è caricato positivamente. Attestazione:ORNL/Andrey Kovalevsky
"Questa scoperta è stata davvero una prova di principio per noi, " ha detto Robert McKenna, professore all'Università della Florida e coautore senior dello studio. "Ci ha aperto gli occhi su come i cambiamenti di temperatura e pH possono influenzare lo stato di protonazione del farmaco, che a sua volta lo rende più o meno efficace."
Nuove informazioni sulle reti di legami idrogeno che costituiscono il sito attivo di hCA II possono aiutare altri scienziati a sviluppare nuovi e migliori farmaci per il trattamento del cancro. La famiglia degli enzimi hCA contiene proteine simili, come hCA IX e XII, che sono associati a tumori al seno aggressivi, come il cancro al seno triplo negativo.
"Vogliamo sfruttare la differenza di carica, pH e temperatura per vedere se possiamo progettare farmaci più efficaci nel colpire questi enzimi, " ha detto Kovalevsky. "Se possiamo capire il legame a livello atomico, possiamo riprogettare i farmaci e trasformarli in "magneti" più forti e selettivi che saranno attratti dagli enzimi associati al cancro. Tali farmaci sarebbero molto più efficaci nell'uccidere le cellule cancerose lasciando intatte le cellule sane, che riduce significativamente gli effetti collaterali per i pazienti".
Molti scienziati hanno utilizzato la cristallografia a raggi X per analizzare le strutture degli enimi di hCA, ma questi studi mancano di informazioni atomiche complete sul legame dei farmaci a causa dell'incapacità dei raggi X di visualizzare gli atomi di idrogeno abbondanti nelle proteine e negli enzimi.
I neutroni sono sensibili agli elementi più leggeri, quindi forniscono informazioni molto più dettagliate sulla posizione degli atomi di idrogeno. Vedere l'idrogeno è fondamentale per studiare gli stati di protonazione di un enzima e di un ligando, una molecola che si lega a una macromolecola biologica, e per analizzare l'architettura delle reti di legame idrogeno. I neutroni offrono anche altri vantaggi sperimentali.
"Quando usi la diffrazione di neutroni non hai danni da radiazioni, così puoi studiare a temperatura ambiente, " disse McKenna. "Inoltre, i cristalli di congelamento possono alterare il farmaco e l'enzima, introducendo una falsa visione nello studio, mentre gli studi sulla temperatura ambiente assomigliano più da vicino all'ambiente in cui verrà utilizzato il farmaco".