Credito:Agenzia giapponese per la scienza e la tecnologia (JST)
Una nuova, È stato sviluppato un catalizzatore di fotoossigenazione biocompatibile che può ossigenare selettivamente e degradare l'aggregazione patogena del peptide amiloide-β (Aβ) correlato alla malattia di Alzheimer (AD) sotto irradiazione con luce nel vicino infrarosso (NIR). Il catalizzatore è stato in grado di ossigenare l'Aβ incorporato sotto la pelle di un topo vivente, e diminuito il livello di Aβ intatto nel cervello di topo modello AD. Il nuovo catalizzatore è potenzialmente applicabile per il trattamento delle malattie amiloidi periferiche e dell'AD.
L'aggregazione tossica del peptide amiloide e della proteina è intimamente correlata a una serie di malattie umane. L'amiloide-β (Aβ) è un peptide amiloide rappresentativo la cui aggregazione è correlata alla patogenesi della malattia di Alzheimer (AD). Lo sviluppo di un sistema chimico artificiale che converte selettivamente aggregati di amiloide tossici in specie non tossiche in condizioni fisiologiche, quindi potenzialmente sopprimendo il processo patogeno, potrebbe essere una nuova strategia terapeutica per trattare malattie amiloidi attualmente incurabili, compreso AD.
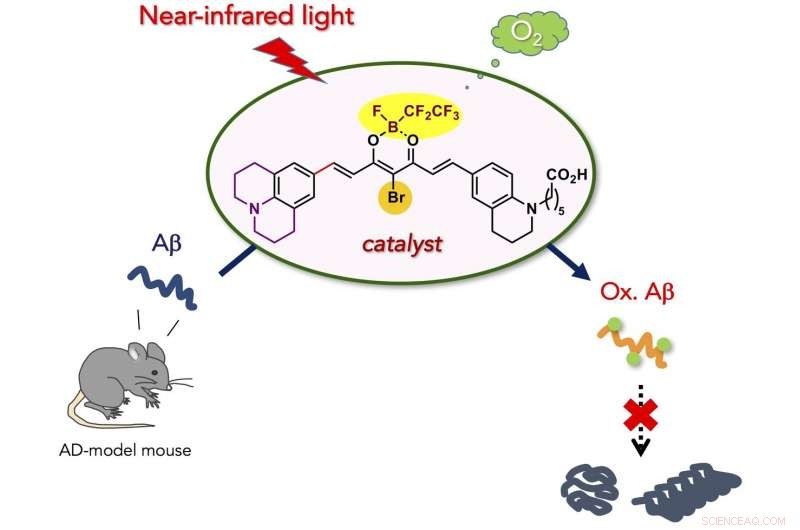
I ricercatori hanno immaginato che l'ossigenazione aerobica fotocatalizzato sarebbe una reazione chimica adatta per attenuare le proprietà aggregative patogene di Aβ in condizioni fisiologiche. Poiché l'aggregazione di peptidi e proteine generalmente dipende da interazioni idrofobiche intermolecolari, installazione covalente di atomi di ossigeno idrofili su un peptide o una proteina (cioè, ossigenazione) diminuirebbe la proprietà aggregativa. Abbiamo precedentemente riportato che l'ossigenazione aerobica di Aβ procede in presenza di fotocatalizzatori a base di Flavina (vitamina B2), e l'Aβ ossigenato risultante mostra una capacità aggregativa e una tossicità molto basse. Successivamente, catalizzatori di fotoossigenazione più selettivi, attivato solo quando rileva una struttura amiloide tossica di ordine superiore, sono stati sviluppati sulla base di una sonda a fluorescenza per proteine e peptidi amiloidi aggregati. L'applicazione in vivo dei catalizzatori è stata, però, irrealizzabile, perché irradiazione con luce visibile, che ha una bassa penetrazione nei tessuti, era necessario per l'eccitazione del catalizzatore. Per applicazioni in vivo, i fotocatalizzatori devono essere in grado di funzionare sotto eccitazione con luce a lunghezza d'onda maggiore, indicata come la "finestra ottica" in cui il tessuto vivente assorbe relativamente poca luce.
Qui, abbiamo sviluppato un catalizzatore di fotoossigenazione biocompatibile che può ossigenare e degradare selettivamente l'aggregazione patogena di Aβ sotto l'irradiazione della luce nel vicino infrarosso (NIR). Il catalizzatore ha mostrato quattro vantaggi principali rispetto ai precedenti catalizzatori per la degradazione dell'Aβ aggregato e tossico:(1) Elevata selettività per l'Aβ aggregato che deriva dall'interruttore on/off di rilevamento della struttura amiloide di ordine superiore per l'attività del catalizzatore. La precisa selettività del bersaglio ha consentito la fotoossigenazione dell'Aβ aggregato in presenza delle cellule e nel lisato cerebrale di topo. (2) Bassa tossicità per le cellule. L'ottimizzazione strutturale del catalizzatore ha ridotto notevolmente la citotossicità, sia al buio che sotto irraggiamento NIR. (3) Elevata potenza di ossigenazione sotto fotoirradiazione NIR. A causa della permeabilità tissutale della luce NIR, la fotoossigenazione dell'Aβ aggregato sotto la pelle del topo è stata possibile con una resa elevata. (4) Applicabilità al cervello di animali viventi in vivo. L'iniezione del catalizzatore nel cervello del topo modello AD insieme all'irradiazione della luce NIR ha portato a una significativa diminuzione del livello di Aβ intatto nel cervello. I risultati ottenuti in questo studio sono un passo importante per l'utilizzo della catalisi artificiale come potenziale strategia terapeutica contro le malattie dell'amiloide.