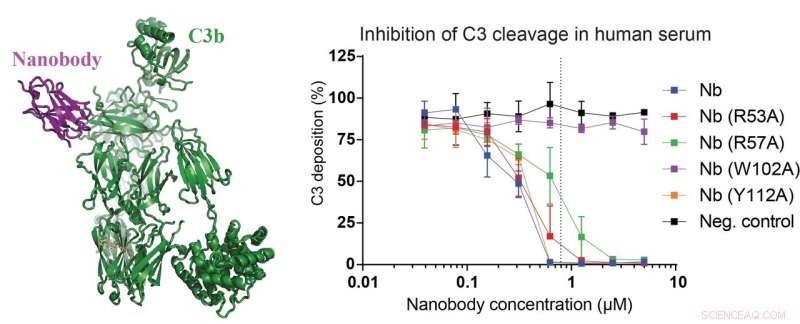
Il pannello sinistro della figura mostra la struttura del nanobody appena sviluppato (magenta) legato a un frammento C3 chiamato C3b (verde). Nei pannelli di destra, dati che dimostrano che il nanobody e i suoi mutanti sono in grado di inibire la scissione di C3 nel 15% di siero umano. I ricercatori hanno anche costruito un mutante nanobody che perde completamente l'effetto inibitorio sulla scissione C3 (curva viola) rendendolo un perfetto controllo negativo. Credito:Rasmus Kjeldsen Jensen e Janus Asbjørn Schatz-Jakobsen, Università di Aarhus
I ricercatori del Dipartimento di Biologia Molecolare e Genetica e del Dipartimento di Biomedicina dell'Università di Aarhus hanno sviluppato e descritto in collaborazione un anticorpo lama che potrebbe avere un impatto significativo per la diagnostica e il trattamento futuri di, per esempio., malattie renali.
Il team di ricerca ha studiato una proteina chiamata C3 dalla parte del sistema immunitario innato noto come sistema del complemento. Al riconoscimento di organismi patogeni o cellule del corpo morenti, C3 viene scisso dagli enzimi del sangue come parte di un meccanismo di difesa. Questi enzimi sono noti come C3 convertasi, e la scissione di C3 risulta in due frammenti. Il frammento chiamato 3b si lega direttamente ai patogeni, mentre l'altro frammento recluta e stimola le cellule immunitarie per eliminare il bersaglio.
In una persona sana, le cellule sono protette dagli effetti della scissione C3. Però, a seguito di mutazioni nel DNA, questa protezione potrebbe andare persa, aumentando il rischio di sviluppare disturbi infiammatori cronici o malattie autoimmuni. Per molto tempo, i ricercatori si sono concentrati sullo sviluppo di agenti che prevengono tale attivazione indesiderata del complemento. Per questa ragione, hanno sviluppato l'anticorpo lama per prevenire la scissione di C3. Gli anticorpi di lama sono anche conosciuti come nanocorpi a causa delle loro piccole dimensioni, e rispetto agli anticorpi normali, sono facili da sviluppare e significativamente più economici da produrre.
"La tecnologia utilizzata per sviluppare e produrre questi nanocorpi è nota da più di due decenni, " dice Gregers Rom Andersen. "E quindi, è in qualche modo sorprendente che siamo i primi al mondo a sviluppare un nanocorpo che inibisce il sistema del complemento".
Esponendo i cristalli ai raggi X e correlando i risultati con i dati della microscopia elettronica, i ricercatori hanno descritto in dettaglio come il loro nanobody si leghi al C3.
"La struttura cristallina del nostro nanobody legato al C3 supporta i nostri modelli proposti in precedenza che descrivono come le convertasi del complemento riconoscono i loro substrati e quindi spiega chiaramente perché il nostro nanobody esercita il suo effetto inibitorio sulla scissione di C3. I nostri risultati migliorano anche la comprensione di base di come questo meccanismo essenziale all'interno del sistema del complemento funziona Confrontando con strutture proteiche precedentemente pubblicate, possiamo inoltre spiegare perché il nostro nanobody inibisce la formazione delle convertasi C3, il nostro nanobody ha un "doppio effetto inibitorio" per così dire, " spiega Rasmus Kjeldsen Jensen.
Oltre al lavoro che descrive il complesso C3-nanobody, il team di ricerca ha anche eseguito diversi esperimenti di laboratorio utilizzando siero di topi e umani. Questi risultati confermano le osservazioni della struttura atomica e rivelano chiaramente che il loro nanocorpo di nuova concezione inibisce la scissione di C3 sia nel siero umano che in quello murino. Quest'ultimo è importante, poiché i topi sono spesso usati come modelli di malattia.
"I nostri esperimenti sul siero sono importanti in quanto mostrano che il nostro nanocorpo funziona effettivamente in condizioni fisiologiche, dove il sistema del complemento esercita naturalmente la sua funzione. Questi risultati indicano che il nostro nanobody potrebbe essere utilizzato nel trattamento di malattie causate dall'iperattivazione del sistema del complemento. Come esempio, parte del rene non è protetta contro il complemento nella stessa misura degli altri tessuti, e in questo caso il nostro nanocorpo potrebbe essere un candidato per fermare la progressione della malattia guidata dal complemento, " dice Gregers Rom Andersen. "Tuttavia, abbiamo anche scoperto che il nostro nanocorpo è in grado di inibire gli effetti protettivi che il nostro corpo normalmente esercita contro il complemento, e si dovrebbe quindi essere molto attenti e valutare meticolosamente i possibili effetti collaterali del trattamento terapeutico delle malattie utilizzando il nostro nanobody, " conclude Gregers Rom Andersen.
Le fondamenta di questo lavoro sono state stabilite dai due Assistant Professor Kasper Røjkjær Andersen e Nick Stub Laursen del Dipartimento di Biologia Molecolare e Genetica, che sono stati i primi in Danimarca a sviluppare e produrre sistematicamente nanocorpi su larga scala. Però, la forza trainante del progetto è stato il dottorando Rasmus Kjeldsen Jensen sotto la supervisione del professor Gregers Rom Andersen, che nella caratterizzazione del nanobody è stato assistito dai due dottorandi Trine Amalie Fogh Gadeberg e Rasmus Pihl.