Target proteico Credito:Elena Khavina/MIPT
Ricercatori del MIPT e di diverse università statunitensi e cinesi hanno risolto la struttura di una delle più importanti proteine del sistema nervoso in complessi con una serie di molecole di farmaci. La scoperta apre opportunità per lo sviluppo di nuovi farmaci con azione regolamentata e minori effetti collaterali. Il documento è stato pubblicato sulla rivista Cellula .
Molti farmaci moderni prendono di mira le proteine poiché sono responsabili della maggior parte delle reazioni fisiche e chimiche in una cellula. Le molecole proteiche consentono inoltre alle cellule di comunicare trasmettendo segnali tra di loro. Quando una persona si ammala, l'armonia nelle cellule è interrotta, quindi i farmaci vengono utilizzati per recuperare l'equilibrio aumentando o riducendo temporaneamente l'attività delle proteine. Molti di loro svolgono funzioni simili e hanno strutture quasi identiche, il che significa che un farmaco può influenzare diversi tipi di proteine. Questa capacità dei farmaci di interagire con più bersagli proteici è chiamata polifarmacologia.
Quando l'approccio molecolare allo sviluppo dei farmaci è stato introdotto per la prima volta, una nozione generale tra i farmacologi era che l'efficacia del farmaco dipendesse da come un particolare medicinale interagiva con una data proteina. L'interazione con altri tipi di proteine, però, si pensava che causasse solo effetti collaterali negativi. Allora allora, lo scopo principale della farmacologia era massimizzare la selettività, cioè la capacità di un farmaco di colpire solo un tipo specifico di proteine. Il concetto ha preso un nome metaforico dal premio Nobel Paul Ehrlich che ha coniato il termine "proiettili magici" per riferirsi a tali farmaci altamente selettivi.
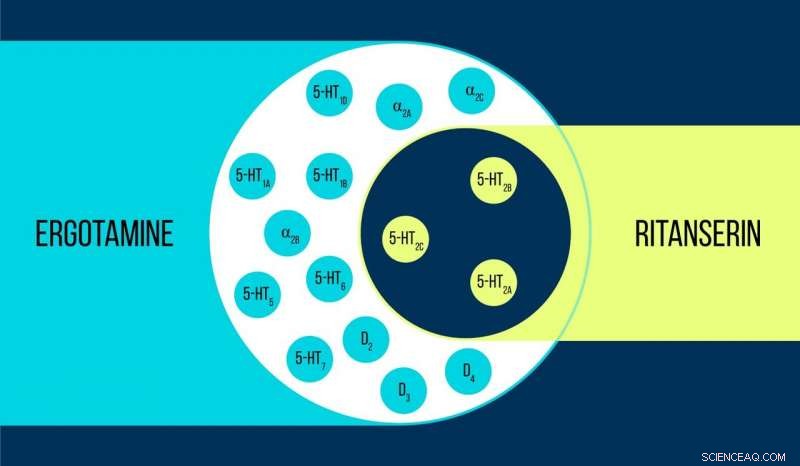
Confronto tra ergotamina e ritanserin Credito:Elena Khavina/MIPT
Però, come spesso accade, il concetto più semplice non è necessariamente il più riuscito. I progressi nelle tecnologie informatiche in chimica e biologia hanno permesso di produrre farmaci estremamente selettivi che hanno agito solo su due o tre sottotipi ravvicinati di una proteina bersaglio. Ma non erano efficaci quanto i loro analoghi a bassa selettività nel trattamento di disturbi complessi come la depressione:i profili polifarmacologici di alcuni farmaci si sono rivelati importanti per i loro effetti benefici. Si è scoperto che la polifarmacologia non causa necessariamente effetti collaterali negativi, tuttavia è importante controllare quali proteine sono interessate. La nozione di "proiettile magico" è stata quindi sostituita dal concetto di "fucile magico", che enfatizza i farmaci con un effetto desiderato su una particolare combinazione di bersagli.
Lo scopo di questa ricerca era identificare le caratteristiche strutturali delle proteine che spiegherebbero perché alcuni farmaci agiscono su di esse in modo selettivo e altri no. Per realizzare lo studio, gli scienziati hanno utilizzato il recettore della serotonina 5-HT2c, una proteina di segnalazione situata nella membrana cellulare, che viene attivato dalla serotonina per ricevere segnali dalle cellule vicine. Il recettore ha una serie di caratteristiche importanti. Primo, è già utilizzato come bersaglio convalidato per i farmaci anti-obesità, pur essendo anche un potenziale bersaglio terapeutico per diversi disturbi mentali. Secondo, è preso di mira da una serie di farmaci con un'ampia gamma di selettività, rendendo possibile il loro confronto. In terzo luogo, un corpo umano ha oltre 800 altri recettori che sono simili nella struttura al 5-HT2c ma svolgono funzioni diverse. Ecco perché i suoi antagonisti non selettivi hanno spesso una moltitudine di effetti collaterali.
Vsevolod Katritch, un visiting professor al MIPT, dice, "Abbiamo usato due sostanze chimiche per lavorare con il recettore della serotonina 5-HT2c:ergotamina e ritanserin. L'ergotamina è un agonista non selettivo con un ampio profilo polifarmacologico:influenza la serotonina, dopamina, e recettori adrenergici. Ritanserin, al contrario, ha un profilo più stretto [figura 1] ed è l'agonista inverso selettivo del recettore 5-HT2c. Così, le strutture atomiche 5-HT2c ottenute in complesso con ergotamina e ritanserin aiutano non solo a spiegare le differenze tra stati recettoriali attivi e inattivi - che è di per sé un risultato considerevole - ma anche a scoprire le ragioni di tale selettività molecolare".
Credito:Istituto di fisica e tecnologia di Mosca
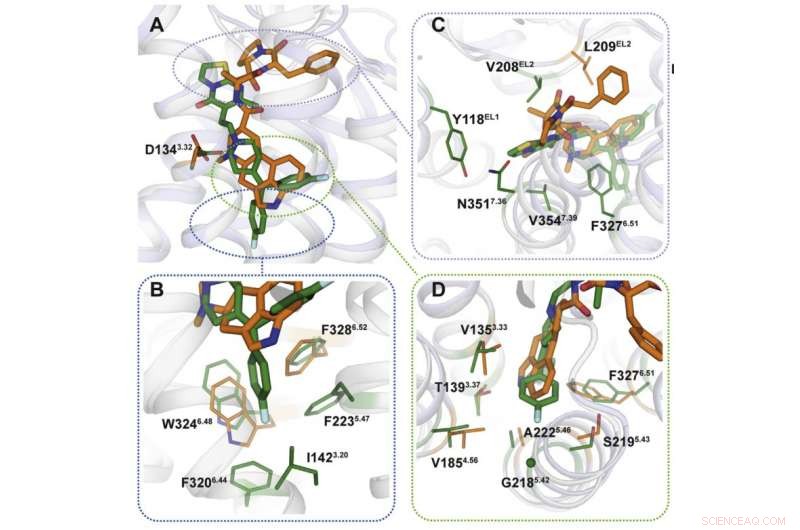
Utilizzando la cristallografia a raggi X, gli scienziati hanno ottenuto un modello 3D delle proteine al momento della loro interazione con i farmaci. prevedibilmente, i meccanismi di legame dei farmaci erano diversi (figura 2). I siti di legame presi di mira dall'ergotamina sono simili in molte proteine, il che spiega la non selettività della sostanza chimica. Ritanserin, d'altra parte, interagisce con il recettore in modo diverso e agisce solo su alcuni dei suoi frammenti che sono unici per un piccolo gruppo di proteine. Introducendo diverse mutazioni che modificano questi frammenti nel gene del recettore 5HT2c, i ricercatori hanno notato che l'interazione con il ritanserin è diventata meno efficace, il che ha confermato che quelle aree proteiche sono quelle responsabili della selettività della sostanza chimica.
Petr Popov, ricercatore presso il Laboratorio di Biologia Strutturale dei recettori accoppiati a proteine G del MIPT, dice, "La sfida principale nell'individuare le strutture recettoriali è stata ottenere uno stabile, costrutto geneticamente modificato che sarebbe adatto per la cristallizzazione e con cui potremmo lavorare e studiare. Utilizzando l'approccio bioinformatica e metodi di apprendimento automatico, abbiamo identificato mutazioni puntiformi stabilizzanti per il recettore 5HT2c sia nei suoi stati attivi che inattivi".
Così, si è dimostrata efficace l'analisi delle caratteristiche strutturali delle proteine in complesso con farmaci a diversa selettività. Può essere utilizzato per controllare l'insieme degli obiettivi e quindi sia gli effetti diretti che quelli collaterali di un farmaco durante il suo sviluppo. Anche, tali medicinali andranno a beneficio di molti pazienti grazie a profili terapeutici migliorati che combattono una varietà di malattie e hanno meno effetti collaterali.