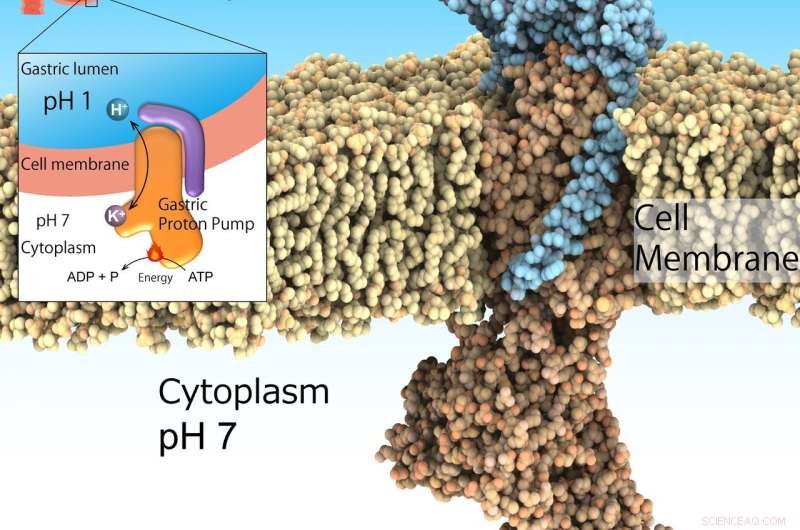
La pompa protonica gastrica, noto anche come H+, K+-ATPasi, si esprime sulla superficie dello stomaco per secernere l'acido gastrico indispensabile per la digestione delle proteine negli alimenti. Però, troppa secrezione acida induce ulcere. La pompa protonica gastrica assorbe i protoni dal citoplasma neutro (pH 7) all'ambiente acido dello stomaco (pH 1) guidato dall'ATP come fonte di energia. Così, è un importante bersaglio farmacologico per le malattie legate all'acido. Credito:Kazuhiro Abe
L'ambiente altamente acido nello stomaco è essenziale per la digestione. Per di più, agisce come un'importante barriera agli agenti patogeni invasivi. Però, l'eccessiva acidificazione dello stomaco porta alle ulcere. Sebbene questa non sia una condizione pericolosa per la vita, può compromettere notevolmente la salute delle persone colpite. La soppressione acida in combinazione con antibiotici è il trattamento riconosciuto per eradicare il batterio Helicobacter pylori, un fattore di rischio per il cancro gastrico. Questo ambiente di pH1 è regolato dall'H . gastrico + , K + -ATPasi, una classe di enzimi che catalizzano H + trasporto dalla soluzione citosolica neutra (pH 7) al lume gastrico acido (pH 1) alimentato dalla fonte di energia cellulare ATP. Quindi, H . gastrica + , K + -ATPasi è un obiettivo importante per i farmaci che trattano la secrezione acida in eccesso dello stomaco.
La principale domanda di ricerca in quest'area di studio è come si possa ottenere un ambiente così altamente acido nello stomaco. Per rispondere a questa domanda, i ricercatori hanno cercato la struttura di H + , K + -ATPasi. Il team ha recentemente pubblicato le sue scoperte in Natura .
"Nel nostro studio, abbiamo usato la cristallografia a raggi X per determinare le strutture dell'H . gastrico + , K + -ATPasi legata a due inibitori della pompa protonica, vonoprazan e SCH28080, " spiega il primo autore Kazuhiro Abe. "Queste informazioni sono importanti sia per il perfezionamento dei farmaci esistenti che per la scoperta di nuovi farmaci".
La cristallografia a raggi X è una tecnica che utilizza modelli di diffrazione dei raggi X per determinare l'alta risoluzione, strutture tridimensionali di molecole come proteine, piccole molecole organiche, e materiali.
Il team ha risolto con successo la struttura cristallina di H + , K + -ATPasi in complesso con vonoprazan o SCH28080 a una risoluzione di 2,8 Å—abbastanza alta da rivelare che i farmaci si sovrapponevano parzialmente ma avevano modalità di legame chiaramente distinte nei loro siti di legame trovati nel mezzo di un condotto che va dal lume gastrico al catione - sito vincolante.
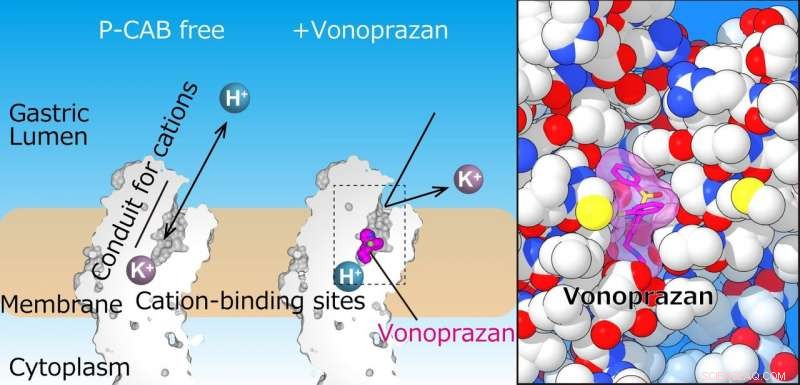
La pompa protonica gastrica esporta H+ nel lume gastrico, che segue l'assorbimento di K+ nel citoplasma. Il pannello di sinistra mostra sezioni del dominio transmembrana della pompa protonica gastrica. Nella struttura attuale, P-CAB (vonoprazan, magenta) si lega nel mezzo della via di trasporto dei cationi (condotto), che blocca il trasporto dei cationi. La vista ingrandita del sito di legame di vonoprazan (magenta) rivela il suo stretto legame con la proteina (a destra). Credito:Kazuhiro Abe
"Le strutture cristalline suggeriscono che la stretta configurazione nel sito di legame del catione abbassa il valore di pKa (una misura della forza acida) dell'acido glutammico al residuo 820 in misura sufficiente da consentire il rilascio di un protone anche nell'ambiente a pH 1 dello stomaco, " afferma l'autore senior Yoshinori Fujiyoshi. "Queste strutture definiscono l'interazione molecolare tra i P-CAB (K + -bloccanti acidi competitivi) e H + , K + -ATPasi, e rivela come H + , K + -ATPasi espelle H + nello stomaco anche a pH1. Tali informazioni contribuiranno in modo significativo alla base di conoscenze per la scoperta di farmaci per le condizioni legate all'eccessiva acidificazione dello stomaco".
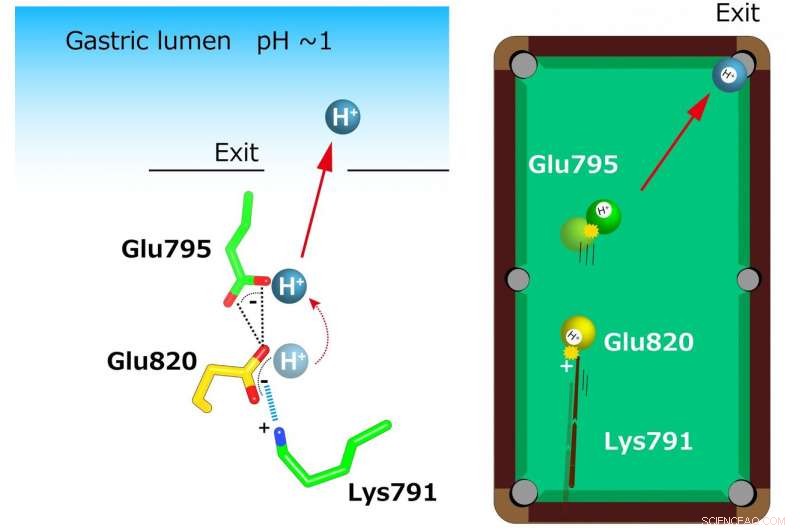
Nella struttura cristallina è stata rivelata una coordinazione insolitamente stretta di due glutammati (Glu795 e Glu820) e una lisina (Lys791) nel sito di legame del catione. Un singolo H+ legato a Glu820 viene estruso dalla carica positiva di Lys791, anche per il lume gastrico altamente acido (a sinistra). Questo meccanismo è paragonato a un modello di biliardo (a destra). Una carica positiva al residuo di lisina funge da "spunto" che spara la "palla gialla" (H+) a Glu820. Questa pallina gialla a sua volta colpisce un'altra H+ (pallina verde) a Glu795 che è esposta al percorso di trasporto dei cationi. Finalmente, una singola pallina (H+) è nella tasca (uscita al lume gastrico). Credito:Kazuhiro Abe