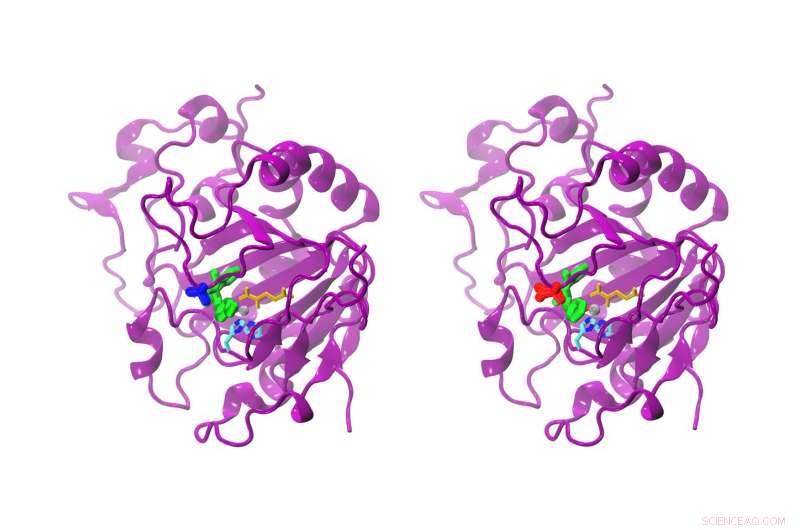
Mentre la differenza tra l'AsqJ naturale e quello modificato è solo un amminoacido, la reattività è chiaramente diversa. L'AsqJ naturale (a sinistra) possiede una valina in posizione 72 (blu). La forma modificata possiede un'isoleucina (rossa) in posizione 72. Il substrato nel sito attivo è di colore verde, alfa-chetoglutarato giallo, l'atomo di ferro grigio, e due catene di istidina ciano e blu. Credito:Sophie Mader/TUM
Praticamente tutti i processi biochimici coinvolgono enzimi che accelerano le reazioni chimiche. Un team di ricerca dell'Università tecnica di Monaco di Baviera (TUM) ha decifrato per la prima volta il meccanismo molecolare dell'enzima AsqJ. Le loro scoperte potrebbero aprire nuove opzioni nella produzione di molecole farmaceuticamente attive.
Senza enzimi, la natura si fermerebbe. Queste minuscole molecole accelerano le reazioni biochimiche o le rendono possibili in primo luogo. Ma come avviene questo a livello molecolare? "Comprendere l'esatta funzione degli enzimi è una delle più grandi sfide della moderna biochimica, "dice Ville Kaila, Professore di Biocatalisi Computazionale presso l'Università Tecnica di Monaco di Baviera.
Il gruppo di ricerca guidato da Ville Kaila e Michael Groll, Professore di Biochimica presso l'Università Tecnica di Monaco di Baviera, avere, per la prima volta, decifrato il meccanismo dell'enzima aspochinolone J (AsqJ), una diossigenasi che attiva i legami del carbonio con l'ossigeno.
L'enzima AsqJ è particolarmente eccitante in quanto catalizza una cascata di reazioni chimiche che alla fine portano alla formazione di composti antibatterici. È stato scoperto solo pochi anni fa nel Aspergillus nidulans fungo. I ricercatori hanno combinato diversi metodi per scoprire i segreti custoditi all'interno dell'enzima:in primo luogo, Alois Bräuer e il prof. Michael Groll hanno utilizzato la cristallografia a raggi X per determinare la struttura atomica tridimensionale della molecola. Sophie Mader e Ville Kaila hanno quindi utilizzato queste informazioni per eseguire simulazioni di meccanica quantistica sui suoi processi biochimici.
"I nostri calcoli illustrano come l'enzima catalizza la formazione di alcaloidi chinolonici, " riferisce Kaila. "Piccoli dettagli hanno effetti sorprendenti:un leggero cambiamento nel substrato, come la rimozione di un piccolo gruppo chimico, è sufficiente per fermare praticamente la reazione."
Prossimo, il team ha progettato in modo computazionale una nuova variante dell'enzima che catalizza la formazione di alcaloidi chinolonici con il substrato modificato. Questo nuovo enzima è stato prodotto sperimentalmente nei batteri e testato per la sua funzionalità. "I risultati sono stati impressionanti:la reazione attesa è avvenuta dopo pochi secondi, " ricorda Bräuer.
"Questo esperimento dimostra che la nostra metodologia funziona ed è adatta anche a rappresentare la funzionalità di altri enzimi a livello molecolare, " afferma Ville Kaila. Il design degli enzimi è ancora a un livello base, ma ha un potenziale enorme. Nel futuro, potremmo puntare alla progettazione computazionale di farmaci, Per esempio.
"Il lavoro dimostra che la nostra metodologia è accurata e adatta anche allo studio della funzionalità di altri enzimi a livello molecolare, " afferma Ville Kaila. Il design degli enzimi è ancora una ricerca di base, ma ha un potenziale enorme. Uno degli obiettivi della ricerca futura sarà quello di progettare enzimi in un computer per, Per esempio, produrre nuovi farmaci.