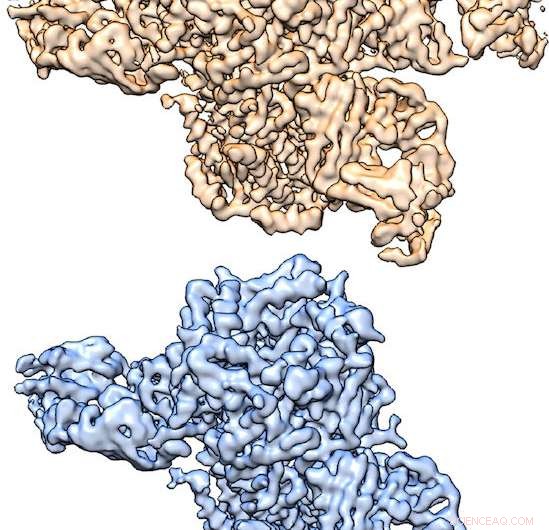
Strutture tridimensionali del recettore nicotinico dell'acetilcolina determinate da cryo-EM, per gentile concessione di Hibbs Lab. Credito:Laboratorio Hibbs, UT Southwestern Medical Center
I ricercatori dell'UT Southwestern oggi pubblicati in Natura progetti su scala atomica della classe più abbondante di recettori nicotinici dell'acetilcolina del cervello. Una comprensione strutturale della proteina, presente nei neuroni, potrebbe portare a nuovi modi per trattare la dipendenza da nicotina dal fumo e dallo svapo.
Strutture tridimensionali del recettore nicotinico dell'acetilcolina determinate da cryo-EM, per gentile concessione di Hibbs Lab. "Quando questo recettore si lega al neurotrasmettitore acetilcolina o alla nicotina, porta all'attivazione del neurone, che poi invia segnali ad altri neuroni, " ha detto il dottor Ryan Hibbs, autore corrispondente dello studio e assistente professore di neuroscienze e biofisica con il Peter O'Donnell Jr. Brain Institute presso UT Southwestern. "Questo processo di 'neurotrasmissione chimica' è alla base di tutte le comunicazioni veloci tra i neuroni. Questo recettore specifico è strettamente legato alla dipendenza da nicotina".
I ricercatori hanno ottenuto le strutture ad alta risoluzione utilizzando la struttura di microscopia crioelettronica (crio-EM) dell'Università da 22,5 milioni di dollari, dove i campioni vengono rapidamente congelati per prevenire la formazione di cristalli di ghiaccio dannosi e quindi visualizzati a meno 321 gradi Fahrenheit (temperature criogeniche). La struttura di UT Southwestern, che funziona 24 ore su 24, è una delle migliori strutture al mondo per la biologia strutturale crio-EM.
Due nuovi aspetti dello studio lo fanno risaltare nei campi della biologia strutturale e delle neuroscienze. Primo, i ricercatori hanno scoperto una nuova biologia su come il recettore lega la nicotina nel cervello, ha detto il dottor Hibbs. In secondo luogo ci sono i risultati relativi agli aspetti tecnici del modo in cui la proteina si assembla.
"La scoperta che abbiamo fatto sui diversi modi in cui la nicotina interagisce con questo recettore può aiutare nella progettazione di farmaci per trattare la dipendenza da nicotina e la neurodegenerazione, " ha aggiunto. "Per quanto riguarda l'assemblaggio del recettore, le tecniche classiche di determinazione della struttura richiedono generalmente un campione omogeneo. Però, per questa proteina, il recettore si assembla in molteplici modi che hanno importanti conseguenze biologiche. Per esempio, uno squilibrio nel rapporto tra le due disposizioni delle subunità è legato sia alla dipendenza da nicotina che all'epilessia congenita".
La proteina che hanno studiato è composta da cinque subunità, di due tipi - α e β. Queste subunità α e si assemblano in due diversi rapporti in due distinti complessi di cinque subunità, una forma 3α:2β e una forma 2α:3β. Complessi di entrambi i rapporti si trovano nel cervello.
"Abbiamo utilizzato un approccio di etichettatura degli anticorpi per identificare le subunità e superare le sfide nel calcolo crio-EM per ottenere strutture di entrambi i complessi di cinque subunità da un singolo campione. Ciò non era stato fatto prima e fornisce un approccio generale per determinare le strutture di molti altri tipi di canali e recettori multisubunità che hanno più modi di assemblarsi, " ha spiegato il dottor Hibbs, uno studioso di ricerca medica Effie Marie Cain.
"Le due strutture sono composte da diversi rapporti di subunità α e β. Utilizzando un anticorpo che si lega solo alle subunità β, siamo stati in grado di estrarre le due strutture da un campione:un recettore ha due anticorpi legati, mentre l'altro ha tre legato, " ha spiegato l'autore principale Richard Walsh Jr., uno studente laureato nel programma di Biofisica Molecolare.
"Essere l'autore principale di un manoscritto accettato è di per sé un'esperienza estremamente gratificante; essere l'autore principale di uno studio accettato da Natura sembra ancora surreale, " Ha aggiunto.
Il laboratorio Hibbs è stato in precedenza in grado di ottenere una struttura di uno dei due complessi mediante cristallografia a raggi X, una prima in quel momento a causa della difficoltà di cristallizzare le proteine di membrana.
"Per le proteine di membrana in particolare, ottenere cristalli che diffrangeranno ad alta risoluzione è impegnativo, che rende il cryo-EM particolarmente potente. In precedenza siamo stati in grado di ottenere uno di questi arrangiamenti di subunità del recettore nicotinico mediante cristallografia a raggi X. Cryo-EM ci ha fornito entrambi gli arrangiamenti, da un singolo campione, a risoluzione maggiore, " ha detto il dottor Hibbs.