
Scienziati dell'Università di Groningen Dr. Hein Wijma (a sinistra) e Prof. Dr. Dick B. Janssen, che ha utilizzato un nuovo approccio computazionale per riprogettare l'enzima aspartasi e convertirlo in un catalizzatore per reazioni di idroamminazione asimmetrica. Credito:Università di Groningen
I biotecnologi dell'Università di Groningen hanno utilizzato un metodo computazionale per riprogettare l'aspartasi e convertirlo in un catalizzatore per reazioni di idroamminazione asimmetrica. I loro colleghi in Cina hanno aumentato la produzione di questo enzima e sono riusciti a produrre chilogrammi di mattoni molto puri per prodotti farmaceutici e altri composti bioattivi. Questo studio di prova di principio di successo è stato pubblicato in Natura chimica biologia il 21 maggio.
Gli enzimi sono catalizzatori naturali che funzionano in condizioni miti. Sono un'alternativa interessante alle reazioni chimiche non catalizzate che spesso richiedono alte temperature o pressioni che consumano energia e possono generare prodotti collaterali tossici o utilizzare solventi. Ma c'è un problema:la gamma di reazioni catalizzate dagli enzimi è limitata. "Ecco perché si stanno facendo molti sforzi per modificare gli enzimi naturali, " spiega Dick Janssen, Professore di biotecnologia chimica presso il Groningen Biomolecular and Biotechnology Institute.
Il metodo classico per modificare gli enzimi è l'evoluzione diretta, una sequenza di mutazione-selezione in laboratorio che mira a creare enzimi con capacità catalitiche modificate. Ma ci vuole molto lavoro per creare e testare centinaia o migliaia di varianti enzimatiche in più cicli. Sarebbe molto più efficiente realizzare una progettazione razionale delle modifiche richieste sulla base delle informazioni sulla struttura e sulle proprietà dell'enzima.
Ma anche questo è complicato, spiega Hein Wijma. È un esperto di software di progettazione molecolare e ha svolto la maggior parte del lavoro computazionale nello studio. "Le proteine sono composte da 20 diversi amminoacidi. Quindi, se vuoi cambiare un enzima in quattro posizioni, ci sono 20 opzioni per ciascuno di essi. Ciò si traduce in un'enorme matrice di strutture proteiche." Testandole una per una, anche al computer, impiega troppo tempo. Però, un algoritmo di ricerca Monte Carlo molto veloce velocizza la scoperta del giusto risultato cercando le tendenze nella reattività dell'enzima.
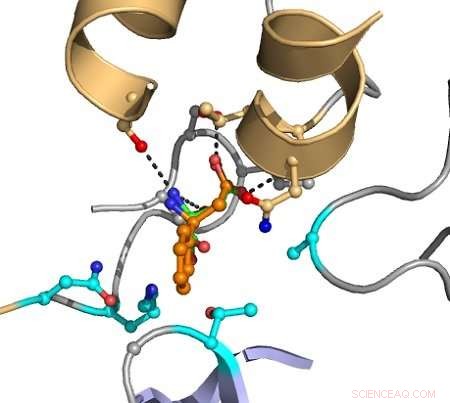
Le linee tratteggiate indicano le interazioni tra gli atomi che causano la catalisi. Il substrato target è mostrato in arancione, ei gruppi indicati in magenta vengono variati nel computer per scoprire mutanti che migliorano la conversione. Credito:Hein Wijma/Università di Groningen
"Alla fine, ci sono voluti un paio di giorni per eseguire questa ricerca in un cluster di computer dedicato presso l'Università di Groningen, " dice Wijma. Ma prima era necessaria molta modellazione. "Devi modellare il centro reattivo, le tasche dove si lega il substrato, e determinare la distanza tra gli amminoacidi e le loro posizioni e angoli relativi." Poiché il gruppo utilizzava un enzima (aspartasi) come punto di partenza per una serie di reazioni diverse, il punto di partenza era sempre lo stesso. Ciò significava che dovevano solo cambiare la reazione target. Wijma:"Se volessimo fare una nuova modifica dell'aspartasi, che probabilmente richiederebbero solo tre mesi ora."
Il documento di ricerca descrive quattro conversioni, tutte le aggiunte di ammonio. L'aspartasi è una deaminasi, quindi la reazione è stata invertita. "La catalisi va in entrambe le direzioni, quindi non è un grosso problema, " dice Janssen. Per ogni conversione, la selezione iniziale da parte dell'algoritmo ha prodotto circa 100 mutanti promettenti. Questi sono stati quindi controllati per errori evidenti. Janssen:"Alla fine, da cinque a 20 mutanti sono stati effettivamente realizzati in laboratorio e testati per vedere se funzionavano come previsto".
Il passo successivo è stato quello di testare enzimi mutanti di successo in un ambiente ingrandito. "Questo lavoro è stato svolto da un ex studente di dottorato e postdoc del nostro laboratorio, Bian Wu, che ora è un assistente professore in Cina, " dice Janssen. "Ha mostrato quali candidati potevano produrre grandi quantità del prodotto richiesto." Le conversioni del substrato del 99 percento con un'enantioselettività del 99 percento sono state ottenute in quantità fino a un chilogrammo, il che significa che gli enzimi previsti dai metodi di calcolo sembrano adatti per l'uso in un ambiente industriale. "Questa è una vera prova di principio che il nostro metodo di selezione in-silico dei mutanti funziona per produrre enzimi utili, " conclude Janssen.