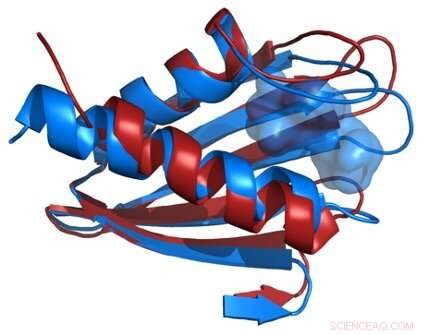
Il confronto delle strutture della spina dorsale proteica Flpp3 come derivate da un laser a elettroni liberi a raggi X (rosso) e da NMR (blu) rivela una cavità interna che è unica per la struttura NMR e quindi suggerisce l'esistenza di strutture proteiche intermedie. Attestazione:James Zook
La tularemia è una malattia rara ma spesso letale. È causato da uno dei patogeni più aggressivi sulla terra, il batterio Francisella tularensis. Il microbo, trasportato da una varietà di animali e insetti, è in grado di entrare e attaccare il corpo attraverso una serie di percorsi, determinando diverse costellazioni di sintomi e gradi di gravità.
La tularemia rimane poco conosciuta e non esiste un vaccino sicuro ed efficace per la malattia. L'estrema letalità di F. tularensis e il suo potenziale di essere aerosolizzato lo hanno anche reso un candidato come arma biologica, aumentando l'urgenza di comprendere la malattia e di sviluppare trattamenti efficaci.
In un nuovo studio, i ricercatori del Biodesign Center for Applied Structural Discovery esaminano una proteina di membrana chiave responsabile della prodigiosa capacità del batterio di infettare il corpo e causare malattie. Questo fattore di virulenza, noto come Flpp3, viene esaminato in dettaglio senza precedenti con l'ausilio di un laser a elettroni liberi a raggi X o XFEL, un enorme e potente acceleratore di raggi X situato presso lo SLAC National Accelerator Laboratory, Stanford.
La tecnologia XFEL utilizza lampi di raggi X brillanti ed estremamente brevi per sondare campioni cristallizzati di Flpp3, rivelando la struttura dettagliata della proteina come mai prima d'ora. Confrontando le informazioni strutturali raccolte dagli esperimenti XFEL con precedenti analisi strutturali mediante NMR, i ricercatori hanno sviluppato un modello più completo della forma elaborata di Flpp3. (Studi precedenti hanno dimostrato che quando un gene che codifica per Flpp3 è disabilitato, gli effetti del patogeno F. tularensis sono significativamente ridotti.)
Gli scienziati sperano di poter utilizzare queste informazioni per sviluppare farmaci mirati in grado di disabilitare le proprietà di virulenza della proteina e proteggere dalla tularemia. I progressi nella comprensione potrebbero anche aiutare gli scienziati a sviluppare un vaccino efficace contro la malattia in futuro. Attualmente, esistono solo vaccini vivi attenuati per la tularemia, e i rischi di infezione e l'immunità insufficiente associati a questo approccio hanno precluso l'uso di tali vaccini negli Stati Uniti.
Il ricercatore di biodesign Dr. James Zook insieme ai professori Petra Fromme e Abhishek Singharoy presso il Centro di biodesign per la scoperta strutturale applicata ha condotto il nuovo studio. È affiancato da colleghi internazionali, compresi i ricercatori di DESY, SLAC, AstraZeneca, il Laboratorio Europeo di Biologia Molecolare di Grenoble, Francia, tra gli altri.
Petra Fromme, direttore del Center for Applied Structural Discovery spiega l'importanza dei risultati:"Questo studio combina, per la prima volta, tecniche XFEL all'avanguardia con NMR e modellazione molecolare per svelare il grande spazio conformazionale di Flpp3. Lo studio svela diverse conformazioni di questa importante proteina per la virulenza del batterio nella struttura XFEL e NMR mostrando così la natura altamente dinamica di Flpp3. Questo studio è così entusiasmante in quanto mostra che conformazioni molto diverse coesistono e vengono convertite l'una nell'altra in condizioni fisiologiche".
Visualizzare la virulenza
Utilizzando dati strutturali dettagliati da NMR e la nuova analisi XFEL del fattore di virulenza della tularemia, i ricercatori hanno identificato un potenziale inibitore di Flpp3. Queste informazioni sono state ottenute da librerie virtuali disponibili contenenti strutture di frammenti di farmaci. Prossimo, un metodo di modellazione basato sulla fisica, nota come dinamica molecolare (MD), ha fornito informazioni dettagliate sulle fluttuazioni e sui cambiamenti conformazionali di atomi e molecole nella proteina legata alla virulenza, aiutare i ricercatori a ottenere una lettura più precisa della struttura e del comportamento di Flpp3.
"Questo lavoro fornisce diverse strutture a risoluzione atomica di un importante fattore di virulenza del batterio che causa la tularemia, " secondo il ricercatore di Biodesign Dr.Debra Hansen, coautore del nuovo studio. Le configurazioni proteiche identificate aiuteranno i ricercatori a perseguire la progettazione basata sulla struttura di farmaci che potrebbero essere efficaci contro la malattia sfuggente, attraverso il targeting e l'inibizione di Flpp3.
Come spiega il co-autore e ricercatore in Biodesign Dr. Abhishek Singharoy, lo studio è degno di nota per essere tra le prime indagini sulla flessibilità conformazionale delle proteine scoperte con cristallografia a raggi X a femtosecondi seriali e NMR e confermate utilizzando simulazioni di dinamica molecolare (MD).
I risultati del gruppo appaiono nell'attuale numero della rivista Cell Press Struttura .
Minaccia persistente
tularemia, nota anche come febbre da coniglio, è una malattia infettiva rara, tipicamente attaccando gli occhi, pelle, linfonodi e polmoni a seguito di infezione da parte del batterio F. tularensis. La malattia è endemica in Nord America, così come in molte parti dell'Europa e dell'Asia, sebbene i casi di tularemia siano rari e le epidemie conclamate tendano ad essere limitate alle regioni con scarsa igiene e inaccessibilità all'assistenza sanitaria moderna.
La tularemia colpisce principalmente i mammiferi, in particolare roditori, conigli e lepri, sebbene a volte infetti anche gli uccelli, pecora, e animali domestici, compresi i cani, gatti e criceti.
La malattia può essere trasmessa all'uomo attraverso punture di insetti e l'esposizione diretta a un animale infetto. La malattia è estremamente contagiosa. Solo 10 cellule batteriche possono essere fatali e un singolo batterio può essere sufficiente a causare l'infezione. L'organismo può vivere per settimane nel suolo, acqua e animali morti.
La tularemia può essere trattata efficacemente se diagnosticata precocemente, anche se il regime di trattamento può essere lungo e complesso. La maggior parte degli infetti da F. tularensis mostra sintomi entro tre-cinque giorni, anche se possono volerci fino a due settimane.
La malattia esiste in una varietà di forme con sintomi diversi, a seconda di come e dove i batteri entrano nel corpo. Questi includono la tularemia ulceroghiandolare, la forma più comune, che produce ulcere della pelle nel sito di infezione, ghiandole linfatiche gonfie e doloranti, febbre, brividi, mal di testa e stanchezza.
Altre forme includono ghiandolare, oculoghiandolare, orofaringeo, polmonare, e tularemia tifoidea. Se non trattata, possono derivare una serie di gravi complicazioni dalla malattia, compresa la meningite, infiammazione dei polmoni, irritazione intorno al cuore e infezione delle ossa.
Metodo di cristallo
Nello studio attuale, una tecnica nota come cristallografia seriale a raggi X a femtosecondi viene utilizzata per sondare la struttura della proteina Flpp3. Qui, brevi e brillanti raffiche di raggi X, circa un miliardo di volte più luminoso dei raggi X convenzionali, colpire un getto di cristalli "volando" attraverso il raggio di raggi X. L'intensa esplosione di raggi X distrugge i cristalli ma prima di farlo, crea un modello di diffrazione su uno schermo. Gli impulsi a raggi X sono ultracorti, della durata di soli 40 femtosecondi, che superano i danni dei raggi X, consentendo la raccolta dei dati a temperatura ambiente in condizioni quasi fisiologiche. (1 fs =10 -15 secondi o un quadrilionesimo di secondo.)
L'assemblaggio di molti di questi raggi X con l'ausilio di computer consente l'assemblaggio di un dettagliato, Struttura 3-D della proteina in studio. Questo cosiddetto metodo di diffrazione prima della distruzione è stato sperimentato per la prima volta da Henry Chapman al Deutsches Elektronen-Synchrotron (DESY) con il team dell'ASU sotto la guida di John Spence e Petra Fromme e dei loro collaboratori.
I ricercatori hanno combinato i nuovi dati strutturali XFEL con i loro precedenti studi NMR di Flpp3, osservando due stati distinti della proteina. Le simulazioni MD hanno rivelato una struttura della cavità interna transitoria, suggerendo che Flpp3 subisce un sottile cambiamento conformazionale.
L'approccio apre le porte allo sviluppo di farmaci mirati volti a ridurre la letalità della tularemia e mostra la potenza delle tecnologie combinate per sbloccare i dettagli della struttura e della dinamica delle proteine.