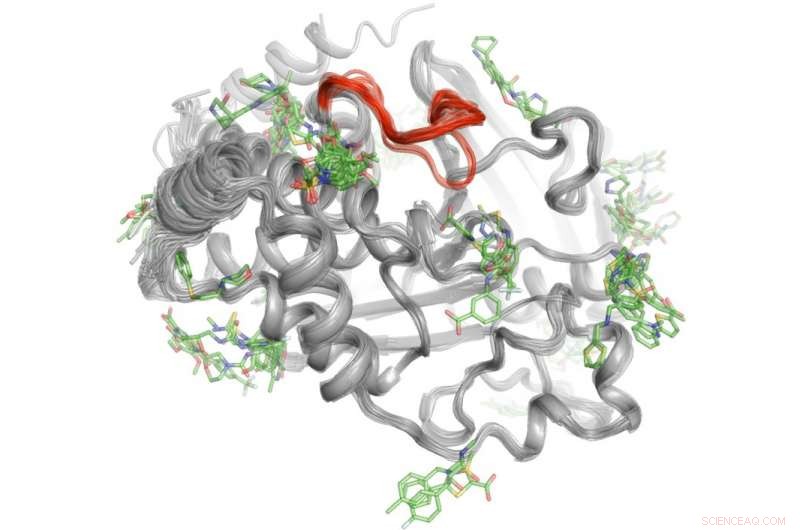
Un metodo ad alto rendimento rivela dove oltre 100 piccole molecole si legano alla proteina PTP1B. Alcune di queste aree di legame possono inviare segnali al sito attivo (rosso) per controllare l'attività di PTP1B." Credito:Daniel Keedy
Le proteine del nostro corpo sono strutture sofisticate che svolgono compiti specifici per mantenerci sani e funzionanti. In molti casi, queste minuscole macchine vengono accese o spente attraverso un processo in due fasi in cui una parte della proteina invia messaggi a un'altra parte chiamata "sito attivo, " innescando la proteina per avviare o interrompere il suo lavoro. A volte questo processo, noto come allosteria, viene interrotto, che porta o contribuisce allo sviluppo di determinate malattie.
Capire come è cablata una proteina potrebbe aiutare i ricercatori a sviluppare modi per controllarne l'attività, e scienziati presso l'Advanced Science Research Center (ASRC) presso il Graduate Center, CUNY, credono di aver trovato un modo affidabile per determinarlo, secondo uno studio appena pubblicato in eLife .
"Proprio come è difficile indovinare come un interruttore della luce sia collegato a una lampadina in una stanza senza vedere dietro le pareti, è difficile prevedere quali aree remote di una proteina sono collegate al suo sito attivo senza vedere i dettagli all'interno della struttura, " ha detto Daniel Keedy, assistente professore con l'iniziativa di biologia strutturale dell'ASRC e con i dipartimenti di chimica e biochimica del City College di New York.
Per risolvere questo mistero, Keedy e i suoi colleghi hanno esplorato le capacità di segnalazione della proteina tirosina fosfatasi 1B (PTP1B), che i ricercatori ritengono svolga un ruolo significativo nel diabete di tipo 2 e possibilmente nel cancro al seno. Per prima cosa hanno usato la cristallografia a raggi X a diverse temperature per vedere come si muovono gli atomi all'interno della proteina. Ciò ha rivelato aree specifiche in cui gli atomi si muovono come i tergicristalli o il giocattolo della culla di Newton per inviare messaggi. Prossimo, il team ha eseguito esperimenti ad alto rendimento con la proteina per determinare quali piccole molecole si legano a questi siti di segnalazione.
"Questo processo in due fasi ci ha permesso di vedere non solo dove ha origine la segnalazione all'interno di PTP1B, ma anche quali piccole molecole sono in grado di inviare messaggi al sito attivo. Questa conoscenza potrebbe un giorno aiutarci a sviluppare terapie che inviano messaggi specifici per controllare l'attività di una proteina e interrompere lo sviluppo del diabete di tipo 2. " ha detto Kedy.
"Sono piuttosto entusiasta delle potenziali applicazioni del lavoro di Daniel, "ha detto Kevin Gardner, direttore dell'iniziativa di biologia strutturale dell'ASRC e professore di chimica e biochimica di Einstein al City College. "Questa tecnica fornisce un potente percorso sperimentale per chiedere dove piccole molecole possono legarsi a bersagli proteici, consentendo la scoperta e lo sviluppo di farmaci mostrando dove si potrebbe essere in grado di trovare "appoggi" precedentemente imprevisti per i composti per legare e controllare l'attività proteica".
Keedy e i suoi colleghi finora hanno esaminato solo PTP1B, ma il loro metodo utilizza tecnologie prontamente disponibili che possono essere utilizzate per studiare il processo di allosteria in molte altre proteine importanti all'interno del nostro corpo. Sperano di ottenere una nuova comprensione di come sono controllate le funzioni di queste altre proteine, che potrebbe essere utile per lo sviluppo futuro di nuove terapie farmacologiche.