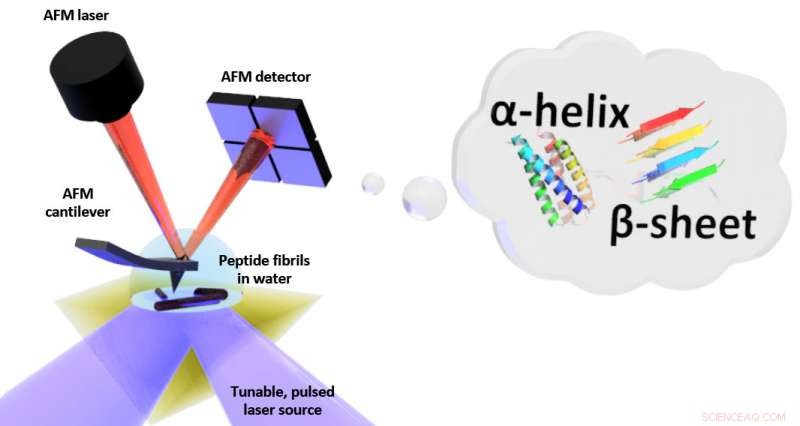
Schema del setup per risonanza fototermica indotta (PTIR), che include una sorgente laser a infrarossi e un microscopio a forza atomica (AFM) a sbalzo con una punta affilata che tocca il campione e vibra in risposta all'espansione indotta dalla luce del campione. PTIR può determinare il modello di piegatura (chiamato ad esempio α-elica, -sheet) di peptidi (catene di amminoacidi) in acqua con risoluzione su scala nanometrica. Credito:NIST
Armeggiare con un metodo che hanno contribuito a sviluppare negli ultimi anni, gli scienziati hanno misurato per la prima volta su scala nanometrica gli schemi caratteristici delle pieghe che danno alle proteine la loro forma tridimensionale in acqua. Sviluppato dai ricercatori del National Institute of Standards and Technology (NIST) e dai loro colleghi, questa tecnica aiuterà gli scienziati a ottenere informazioni sul comportamento delle biomolecole in ambienti acquosi simili a quelli delle cellule. Queste intuizioni, a sua volta, potrebbe aumentare la nostra comprensione delle principali malattie, compreso l'Alzheimer, che sono legati a "errori" nel ripiegamento delle proteine.
La vita come la conosciamo non potrebbe sopravvivere se le proteine non si ripiegassero in schemi precisi che portavano alle eliche, fogli e altre forme che conferiscono alle proteine la loro struttura tridimensionale. Le forme precise delle proteine consentono loro di trasportare ossigeno, respingere i batteri nocivi ed eseguire altri compiti essenziali nel corpo. Le proteine che si ripiegano in modo improprio non possono funzionare e talvolta generano frammenti tossici, come quelli associati a malattie neurodegenerative.
Per comprendere la complessità del piegamento, gli scienziati devono studiare la disposizione dettagliata delle catene di amminoacidi che sono più corte e più semplici delle proteine, chiamate peptidi, e come si piegano, assemblare e ruotare per creare una varietà di forme, o conformazioni. I biologi preferiscono esaminare proteine e peptidi immersi nell'acqua perché quell'ambiente si avvicina molto alle condizioni all'interno delle cellule viventi.
Tecniche precedentemente stabilite per determinare la conformazione delle proteine, come la spettroscopia infrarossa, mancano della risoluzione spaziale fine per studiare i piccoli e diversi assemblaggi di proteine correttamente piegate e mal ripiegate. Inoltre, queste tecniche non funzionano bene in un ambiente acquoso perché l'acqua assorbe fortemente la luce infrarossa, confondendo l'analisi. L'acqua aveva anche posto gravi sfide per una tecnica pionieristica, nota come risonanza fototermica indotta (PTIR), che di recente ha consentito ai ricercatori di esaminare la struttura e la conformazione dei peptidi nell'aria con una risoluzione su scala nanometrica.
I ricercatori del NIST ei loro colleghi hanno ora dimostrato che il PTIR può essere adattato per ottenere una struttura conformazionale su scala nanometrica in acqua utilizzando due peptidi chimicamente simili noti come difenilalanina e Boc-difenilalanina. La difenilalanina è correlata alla beta-amiloide, un appiccicoso, peptide più grande legato alla malattia di Alzheimer.
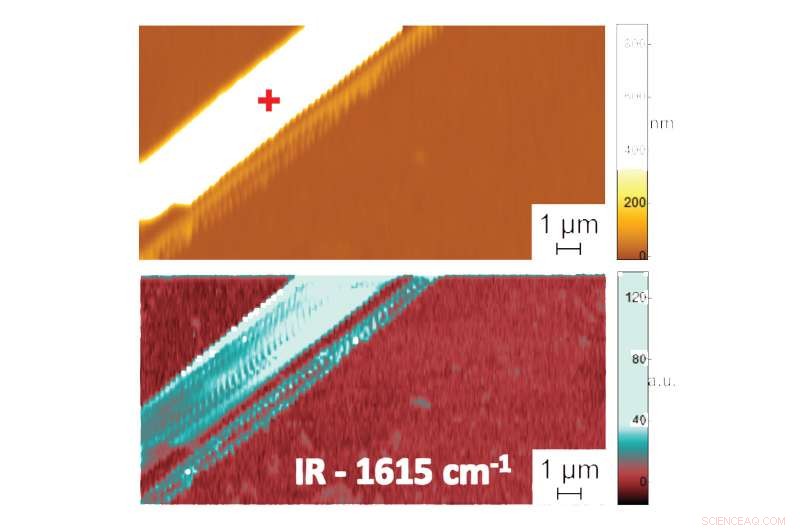
Appare in:La forma nell'acqua:prime misurazioni su scala nanometrica della struttura piegata delle biomolecole nei liquidi. Immagine al microscopio a forza atomica che mostra la topografia (in alto) e l'immagine di assorbimento PTIR che indica la composizione e la conformazione (in basso) di una fibrilla peptidica di difenilalanina in acqua. Dati aggiuntivi, registrando lo spettro della radiazione infrarossa assorbita dalle fibrille peptidiche, fornisce informazioni sul loro modello di piegatura. Lo spettro PTIR indicato, Per esempio, che la difenilalanina assume una pura conformazione a foglio β antiparallelo. Credito:NIST
"PTIR è una tecnica potente che aveva già mostrato risultati promettenti per lo studio dei sistemi biologici, ma la possibilità di utilizzarlo con campioni in ambiente liquido migliorerà notevolmente il suo utilizzo in quest'area, " ha affermato Georg Ramer del NIST e dell'Università del Maryland a College Park. Ramer e il ricercatore del NIST Andrea Centrone, insieme ai loro colleghi dell'Università di Cambridge in Inghilterra, descritto il loro lavoro in un articolo recentemente pubblicato online su ACS Nano .
PTIR determina la composizione chimica dei materiali con risoluzione su scala nanometrica combinando un microscopio a forza atomica (AFM) con la luce di un laser a infrarossi che opera su una gamma di lunghezze d'onda. Le lunghezze d'onda caratteristiche della luce infrarossa assorbite dal campione sono simili a un'impronta digitale molecolare, rivelandone la composizione chimica. In ogni punto del campione in cui viene assorbito l'infrarosso, il materiale si riscalda, facendolo rapidamente, ma mai così leggermente, espandere. L'espansione viene rilevata, con la punta acuminata dell'AFM che sporge da un cantilever, che oscilla come un trampolino ogni volta che il campione si espande. Più luce viene assorbita dal campione, maggiore è la sua espansione e maggiore è la forza, o ampiezza, delle oscillazioni.
Per quanto PTIR sia buono, l'uso del metodo in un ambiente acquatico è problematico. L'acqua assorbe fortemente la luce infrarossa, producendo un segnale di assorbimento che può interferire con gli sforzi per discernere la struttura chimica del campione. Inoltre, la forza di trascinamento esercitata dall'acqua è molto più forte che nell'aria e tipicamente indebolisce il segnale PTIR, in quanto smorza fortemente le oscillazioni del cantilever dell'AFM.
Per limitare l'assorbimento della luce infrarossa da parte dell'acqua, il team ha posizionato un prisma tra il laser e il campione. Il prisma serviva a confinare la luce infrarossa sulla superficie del campione, minimizzando la quantità che potrebbe fuoriuscire e interagire con l'acqua. Per risolvere il problema dello smorzamento, il team ha utilizzato un laser in grado di operare a frequenze fino a 2, 000 kilohertz. Ciò ha permesso ai ricercatori di abbinare la frequenza degli impulsi laser a una delle frequenze più alte a cui oscilla il cantilever. Come spingere un bambino su un'altalena al giusto intervallo, l'adattamento di frequenza ha migliorato l'ampiezza delle oscillazioni del cantilever, compensando parzialmente lo smorzamento dovuto all'acqua.
Per dimostrare l'accuratezza del loro metodo, il team ha confrontato le misurazioni PTIR di difenilalanina e altri campioni di peptidi in due ambienti:acqua e aria. (I peptidi si ripiegano in modo simile in entrambi i mezzi, rendendo più facile eseguire il confronto.) Sorprendentemente, gli scienziati hanno ottenuto una risoluzione spaziale e un contrasto simili in acqua e aria, dimostrare per la prima volta che le misurazioni in un ambiente acquatico possono essere eseguite con precisione, rivelando la precisa conformazione dei peptidi con risoluzione su scala nanometrica.
"Questa scoperta è importante per i biologi che vogliono comprendere la struttura e il ripiegamento delle proteine in ambienti il più vicino possibile a quelli delle cellule, " disse Centrono.