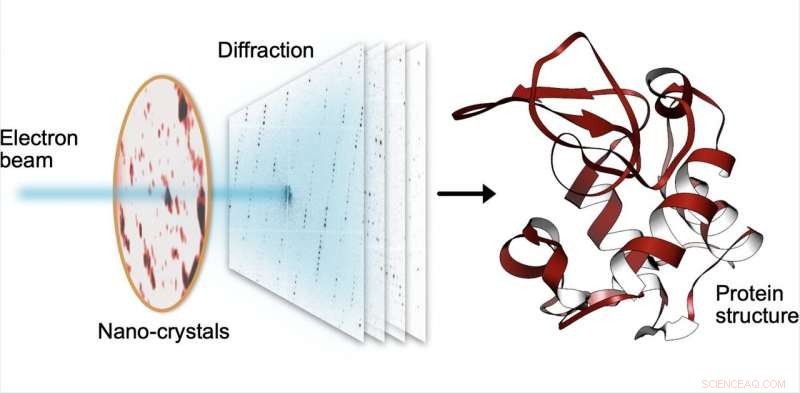
Nella diffrazione elettronica seriale, un piccolo fascio di elettroni colpisce in sequenza migliaia di minuscoli cristalli costituiti da proteine, che disperdono il raggio in schemi di diffrazione. Da quegli schemi, la struttura delle proteine può essere determinata con alta risoluzione. Credito:Robert Bücker
Comprendere la struttura delle proteine, gli elementi costitutivi della vita, è essenziale per ottenere informazioni sulla loro funzione biologica. Per le loro minuscole dimensioni e l'estrema fragilità, queste strutture sono enormemente difficili da determinare. L'acquisizione di dati con una risoluzione sufficiente richiede enormi dosi di radiazioni a raggi X ad alta energia, che purtroppo danneggia irrevocabilmente le proteine principalmente indagate.
Ora i ricercatori dell'MPSD e del DESY di Amburgo hanno sviluppato un nuovo metodo inventivo che evita queste insidie e utilizza tecnologia conveniente. Il loro lavoro che descrive il nuovo metodo è stato ora pubblicato in Comunicazioni sulla natura .
Per decenni, ricercatori di molti campi come la fisica, biologia, e la biochimica hanno riversato la loro creatività nell'eludere l'enigma del danno da radiazioni. Gli approcci attuali includono l'uso di lampi a raggi X estremamente brevi e intensi in strutture come il nuovo laser europeo a elettroni liberi a raggi X (EuXFEL) ad Amburgo, che può acquisire immagini di proteine ben esposte prima di farle letteralmente esplodere.
Sebbene questo metodo abbia avuto un successo spettacolare nell'ottenere strutture proteiche ad alta risoluzione, la generazione di fasci di raggi X della luminosità richiesta richiede l'uso di grandi e costosi acceleratori di particelle. Un'alternativa altamente efficace, che viene praticato in modo intensivo presso il Center for Structual Systems Biology (CSSB) di Amburgo, Per esempio, è rinunciare del tutto ai raggi X, e utilizzare invece fasci di elettroni, che sono più delicate con le delicate biomolecole e più facili da generare.

Un film al rallentatore di raccolta di modelli di diffrazione (a sinistra) da migliaia di minuscoli cristalli (a destra) in un microscopio elettronico. Credito:Robert Bücker
Il team di ricerca MPSD/DESY presso il Center for Free-Electron Laser Science (CFEL) ha ingegnosamente combinato tali metodologie con il calcolo dei big data e i recenti miglioramenti nella tecnologia delle fotocamere ed è riuscito a ottenere strutture proteiche ad alta risoluzione da nanocristalli relativamente facilmente ottenibili. Per realizzare questo, hanno sviluppato una tecnica chiamata diffrazione elettronica seriale adattando metodi sperimentali già noti nella comunità della cristallografia a raggi X per acquisire ed elaborare in sequenza modelli di diffrazione da migliaia di cristalli.
Invece di utilizzare uno strumento da un miliardo di euro come EuXFEL, hanno semplicemente distribuito questi cristalli su un sottile film di carbonio e li hanno inseriti in un microscopio elettronico a trasmissione, un dispositivo onnipresente. Il fascio di elettroni viene fatto saltare da un nanocristallo all'altro per acquisire dati di diffrazione. Oltre al risparmio di materiale su campioni spesso rari e costosi, l'utilizzo di nanocristalli significa che i ricercatori non devono più coltivare grandi cristalli proteici come richiesto dai metodi più vecchi (a raggi X), un'impresa che spesso si rivela proibitivamente difficile.
Per aggirare il danno causato dal fascio di elettroni, invece di scattare una sola fotografia, un breve filmato viene registrato utilizzando una telecamera ad alta velocità mentre il fascio di elettroni è appoggiato su ciascun cristallo. Nel film, si può letteralmente guardare le proteine nel cristallo "sciogliersi", tuttavia, ci sono abbastanza informazioni in questo film di diffrazione durante la distruzione per ricostruire i dati quasi come se non ci fosse alcun danno. Questa procedura viene ripetuta per migliaia di nanocristalli, e in poche ore, utilizzando un software specializzato sviluppato presso DESY, l'enorme quantità di dati viene convertita in una struttura proteica ad alta risoluzione.
Oltre alle proteine e ad altre biomolecole, la diffrazione elettronica seriale è applicabile anche a molte classi di nuovi materiali funzionali, come le perovskiti e le strutture metallo-organiche, tutti candidati promettenti per future applicazioni nelle celle solari e nello stoccaggio dell'idrogeno. Il team di ricerca è entusiasta della facilità d'uso di questa tecnica innovativa, con i suoi requisiti di attrezzatura bassi e l'ampia applicabilità. Anticipano che si diffonderà dal MPSD ai laboratori di tutto il mondo.