Un recente articolo descrive come l'eme è accompagnato dalle sue proteine bersaglio. Credito:Dennis Stuehr, Clinica di Cleveland
Ti piace respirare aria? Dovresti dedicare un pensiero ogni tanto a eme, una molecola contenente ferro essenziale per tutti gli organismi impegnati in uno stile di vita che respira aria. Le molecole di eme sono la parte più famosa dell'emoglobina, la proteina che trasporta l'ossigeno nel sangue, ma sono anche componenti di numerose altre proteine coinvolte nel trasporto dei gas e nella chimica fondamentale nelle cellule. Da solo, l'eme è tossico e reattivo, ma se inserito correttamente in determinate proteine, è assolutamente essenziale.
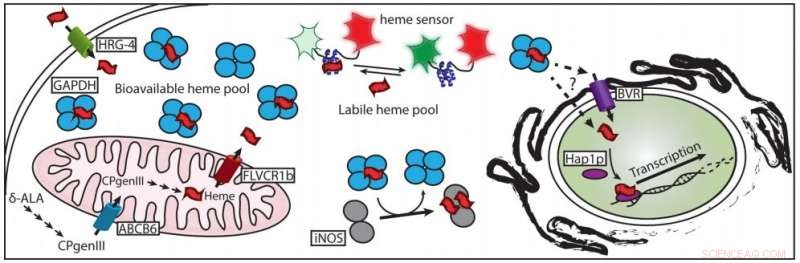
Fino a poco tempo fa, un mistero fondamentale sull'eme è rimasto irrisolto:come viene dai mitocondri, dove è fatto, alle proteine in altre parti della cellula dove è necessario?
Un team di ricercatori del Lerner Research Institute della Cleveland Clinic ha ora risolto questo enigma di vecchia data identificando la proteina che "accompagna" l'eme libero nelle cellule legandosi ad esso, impedendogli di danneggiare la cella fino a quando non viene consegnato dove è necessario. I risultati sono pubblicati nel Journal of Biological Chemistry .
Dennis Stuehr, lo sperimentatore della Cleveland Clinic che ha supervisionato il nuovo studio, era stato interessato per anni al mistero dello sconosciuto accompagnatore eme. "Era sorprendente che in realtà non si sapesse quasi nulla, "Stuehr ha detto. "Nella letteratura, sembra che tutti abbiano spento le luci e siano tornati a casa".
Poco a poco, Il team di Stuehr ha messo insieme la biochimica dell'eme libero. Il primo passo è stato scoprire semplicemente a quali proteine si può legare l'eme. Quindi, avevano bisogno di sperimentare per vedere quale delle proteine che l'eme si attacca per aiutarlo effettivamente a raggiungere la sua destinazione finale.
"Heme è un po' appiccicoso; si lega a molte cose, " disse Elizabeth Sweeny, il borsista postdottorato che è stato uno dei co-leader del nuovo studio. "Questo (studio) è stata la prima volta che abbiamo trovato una proteina che non solo lega l'eme, e ne lega molto, ma è anche necessario per la consegna ai bersagli della proteina eme a valle".
Il nuovo studio utilizza diverse linee di prova per implicare un giocatore inaspettato come chaperone dell'eme:la gliceraldeide 3-fosfato deidrogenasi, o GAPDH. GAPDH è un enzima coinvolto nella scomposizione dello zucchero nelle cellule. è un luogo comune, componente non affascinante del metabolismo di base della cellula, tanto che gli scienziati di laboratorio lo usano principalmente come controllo di base negli studi di altre proteine.
"GAPDH è un candidato così ridicolo, " Stuehr ha detto. "Ma c'è stata questa storia emergente che GAPDH non è solo questo noioso enzima glicolitico che è in ogni cellula; ha questi altri ruoli nella biologia cellulare. E la consegna dell'eme è uno di questi nuovi ruoli".
GAPDH potrebbe non essere l'unica proteina coinvolta nell'eme chaperoning, Stuehr aggiunge, e la ricerca su ulteriori dettagli su come viene erogato l'eme è in corso.
"La nostra scoperta risponde a una domanda sulla biologia cellulare che esiste da un po' di tempo, per quanto riguarda il meccanismo di consegna di questa biomolecola essenziale, " ha detto Stuehr. "Ora possiamo pensare ed esplorare come l'interruzione di questo processo di consegna potrebbe effettivamente contribuire a una serie di malattie, (come) anemie, asma e altro".